学术动态
施福东团队《Science》发现靶向甲酰肽受体1抑制神经炎症与退行,为神经疾病治疗开辟新路径
作者:李治国 来源自:中国免疫学会 点击数:4973 发布时间:2025-12-03
2025 年11 月 14 日,天津医科大学总医院/北京天坛医院施福东教授团队在《Science》在线发表了题为“Targeting formyl peptide receptor 1 reduces brain inflammation and neurodegeneration”的研究论文。这项研究聚焦中枢神经系统自身免疫性疾病多发性硬化(multiple sclerosis, MS),揭示了甲酰肽受体1(formyl peptide receptor 1, FPR1)驱动脑区域性炎症和神经退行的新机制,充分验证了FPR1能够作为治疗靶点,研发了全新小分子化合物T0080并在临床前确定其疗效,为多发性硬化等许多神经疾病的治疗带来了新曙光。
多发性硬化是一种中枢神经系统(central nervous system, CNS)慢性炎性脱髓鞘疾病,是全球青壮年非创伤致残的首要病因,其病程涉及脑内区域化免疫炎症和不可逆的神经退行性损伤。现有MS治疗手段多作用于外周免疫系统,尚难有效遏制脑内病灶的持续恶化,表现在:1)现有MS疾病修饰治疗药物虽然可以有效控制外周免疫系统和减少MS复发,但对脑内慢性的区域化炎症和退行性病变的治疗效果有限,无法显著延缓脑萎缩或改善神经退行病变,患者仍面临神经功能残疾进展的风险。2)MS神经退行涉及线粒体损伤、氧化应激、轴突脱髓鞘和慢性脑内区域炎症等多重机制,单一外周免疫靶点难以有效干预。尽管过去半个世纪在全球范围内投入了大量研究资源,仍未发现能够在临床上明确改善MS神经退行的药物。由于神经炎症与退行几乎存在于所有CNS疾病中,导致数十亿患者出现不同程度的神经功能缺失,造成沉重的家庭、社会和经济负担。因此,明确CNS炎症与退行性变的分子机制并开发相应治疗策略,成为医学和生物学领域重大攻关焦点。
揭开中枢神经系统疾病的关键机制
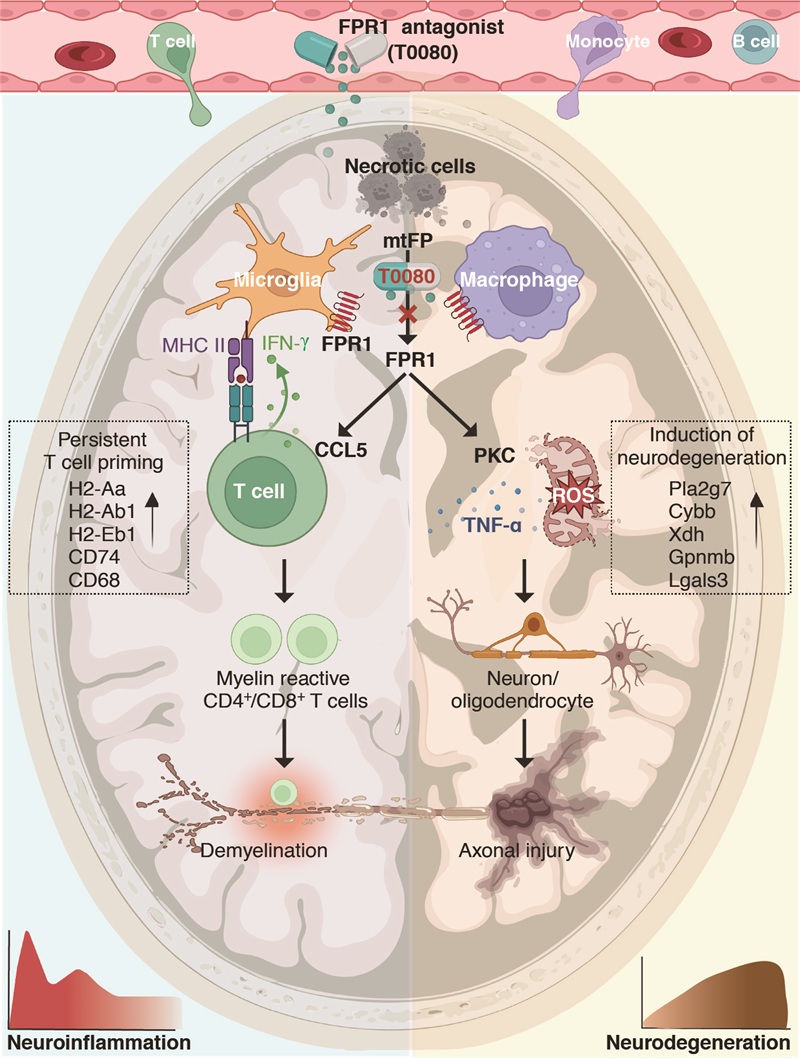
施福东院士与Wee Yong院士在2025年6月发表于《Science》的观点文章(PMID: 40536983)指出:中枢神经系统(CNS)损伤,无论急性(脑外伤、脑卒中和癫痫等)还是慢性(多发性硬化、阿尔茨海默病等),都会触发两个核心病理过程,即CNS免疫与炎症反应和神经退行性变。围绕MS神经退行的机制和干预难题,施福东教授团队研究发现MS患者的CNS病灶区域中,受损和死亡的细胞会释放线粒体甲酰肽,激活脑内小胶质/巨噬细胞的甲酰肽受体1,进而促进脑内炎症区域化,并引发神经退行。研究团队借助单细胞测序、脑病灶原位病理以及患者体液标记物检测等手段,揭示了MS患者活跃病灶中细胞坏死、天然免疫激活和神经退行的分子互作网络,并通过临床大队列数据证实FPR1及其配体线粒体甲酰肽与MS患者病灶活动度和疾病进展的相关性。在机制研究中发现:一方面,FPR1信号增强小胶质细胞的抗原递呈能力,维持CNS局部髓鞘反应性T细胞的克隆扩增,破坏髓鞘完整性;另一方面,FPR1信号介导的神经退行主要通过调控脑内区域性免疫和炎症反应,而非外周免疫活化,揭示不同于现有的靶向外周免疫的全新神经退行机制和潜在治疗靶点。另外,FPR1信号通过激活蛋白激酶C,增强小胶质细胞和巨噬细胞释放活性氧等神经毒性因子,导致神经元凋亡、轴突丢失、线粒体功能障碍和脑萎缩等典型神经退行性病变。
筛选并验证新型治疗药物
为干预FPR1介导的脑内区域炎症和神经退行,研究团队采用计算机辅助药物设计等技术,从数百万小分子中筛选并优化出可穿越血脑屏障的FPR1小分子拮抗剂T0080。在三种MS小鼠模型中,T0080均可显著抑制FPR1活化,减少脑内炎症及神经退行性变的进展(图)。本研究进一步完善了CNS炎症与退行机制的理论体系,并创造出全新的FPR1拮抗剂T0080作为治疗MS的候选药物,为阿尔茨海默病、帕金森病和脑卒中等存在共同神经退行特征的疾病治疗提供了新思路和新方法。
本研究的通讯作者为天津医科大学总医院 / 北京天坛医院神经科主任医师, 欧洲科学院院士施福东;共同第一作者为天津医科大学总医院李裕林住院医师和李治国副研究员。课题组感谢吉林大学中日联谊医院韩雪梅、上海交通大学瑞金医院陈晟、重庆医科大学附属第一医院冯金洲、山西医科大学第一医院孟华星、唐都医院郭俊、广州市第一人民医院汪鸿浩、郑州大学第一附属医院刘洪波以及德国Charité – Universitätsmedizin Berlin大学Friedemann Paul等提供了多发性硬化患者的临床资料和样本;以及贺文艳、史凯斌、李敏淑和金薇娜等京津神经免疫中心(Beijing-Tianjin Center for Neuroinflammation, BTCN)许多成员的协同攻关。该项目由国家自然科学基金等多项基金资助。
文章链接:https://www.science.org/doi/10.1126/science.adq1177
多发性硬化是一种中枢神经系统(central nervous system, CNS)慢性炎性脱髓鞘疾病,是全球青壮年非创伤致残的首要病因,其病程涉及脑内区域化免疫炎症和不可逆的神经退行性损伤。现有MS治疗手段多作用于外周免疫系统,尚难有效遏制脑内病灶的持续恶化,表现在:1)现有MS疾病修饰治疗药物虽然可以有效控制外周免疫系统和减少MS复发,但对脑内慢性的区域化炎症和退行性病变的治疗效果有限,无法显著延缓脑萎缩或改善神经退行病变,患者仍面临神经功能残疾进展的风险。2)MS神经退行涉及线粒体损伤、氧化应激、轴突脱髓鞘和慢性脑内区域炎症等多重机制,单一外周免疫靶点难以有效干预。尽管过去半个世纪在全球范围内投入了大量研究资源,仍未发现能够在临床上明确改善MS神经退行的药物。由于神经炎症与退行几乎存在于所有CNS疾病中,导致数十亿患者出现不同程度的神经功能缺失,造成沉重的家庭、社会和经济负担。因此,明确CNS炎症与退行性变的分子机制并开发相应治疗策略,成为医学和生物学领域重大攻关焦点。
揭开中枢神经系统疾病的关键机制
施福东院士与Wee Yong院士在2025年6月发表于《Science》的观点文章(PMID: 40536983)指出:中枢神经系统(CNS)损伤,无论急性(脑外伤、脑卒中和癫痫等)还是慢性(多发性硬化、阿尔茨海默病等),都会触发两个核心病理过程,即CNS免疫与炎症反应和神经退行性变。围绕MS神经退行的机制和干预难题,施福东教授团队研究发现MS患者的CNS病灶区域中,受损和死亡的细胞会释放线粒体甲酰肽,激活脑内小胶质/巨噬细胞的甲酰肽受体1,进而促进脑内炎症区域化,并引发神经退行。研究团队借助单细胞测序、脑病灶原位病理以及患者体液标记物检测等手段,揭示了MS患者活跃病灶中细胞坏死、天然免疫激活和神经退行的分子互作网络,并通过临床大队列数据证实FPR1及其配体线粒体甲酰肽与MS患者病灶活动度和疾病进展的相关性。在机制研究中发现:一方面,FPR1信号增强小胶质细胞的抗原递呈能力,维持CNS局部髓鞘反应性T细胞的克隆扩增,破坏髓鞘完整性;另一方面,FPR1信号介导的神经退行主要通过调控脑内区域性免疫和炎症反应,而非外周免疫活化,揭示不同于现有的靶向外周免疫的全新神经退行机制和潜在治疗靶点。另外,FPR1信号通过激活蛋白激酶C,增强小胶质细胞和巨噬细胞释放活性氧等神经毒性因子,导致神经元凋亡、轴突丢失、线粒体功能障碍和脑萎缩等典型神经退行性病变。
筛选并验证新型治疗药物
为干预FPR1介导的脑内区域炎症和神经退行,研究团队采用计算机辅助药物设计等技术,从数百万小分子中筛选并优化出可穿越血脑屏障的FPR1小分子拮抗剂T0080。在三种MS小鼠模型中,T0080均可显著抑制FPR1活化,减少脑内炎症及神经退行性变的进展(图)。本研究进一步完善了CNS炎症与退行机制的理论体系,并创造出全新的FPR1拮抗剂T0080作为治疗MS的候选药物,为阿尔茨海默病、帕金森病和脑卒中等存在共同神经退行特征的疾病治疗提供了新思路和新方法。

图:甲酰肽受体1(FPR1)通路维持脑区域炎症(左半球)和诱导神经退行(右半球);甲酰肽受体1小分子拮抗剂(T0080)能够减缓脑内炎症及神经退行
过去二十年来,神经免疫领域普遍认为:外周迁移到CNS的单核巨噬细胞和神经胶质细胞介导的天然免疫反应是驱动多发性硬化进展的主要因素。 施福东在神经免疫领域长期深耕,通过敏锐的洞察力带领课题组溯源髓系细胞的来源,在2022年发表于《Cell》期刊(史凯斌等,PMID: 35709748)中揭示了多发性硬化患者骨髓髓系细胞异常增殖,通过趋化因子CCR5介导迁移中枢神经系统,促进疾病进展。在此基础上,与上海药物研究所柳红课题组合作共同开发新型CCR5抑制剂赛拉维诺,可有效阻止髓系细胞回归CNS,减少神经炎症和退行病变,于2025年5月获得国家药监局I类新药临床试验(IND)批准。目前,塞拉维诺治疗多发性硬化的II期临床实验(THIRL-MS)已经启动。此次发表在《Science》的研究成果,再次实现了对多发性硬化进展机制的延续性突破。目前,施福东课题组与药物研发团队合作,正积极优化T0080特性和推动进入临床实验,未来有望为多发性硬化和其他神经疾病如脑卒中、阿尔茨海默病等提供全新的治疗方案。
研究的延续与拓展
本研究的通讯作者为天津医科大学总医院 / 北京天坛医院神经科主任医师, 欧洲科学院院士施福东;共同第一作者为天津医科大学总医院李裕林住院医师和李治国副研究员。课题组感谢吉林大学中日联谊医院韩雪梅、上海交通大学瑞金医院陈晟、重庆医科大学附属第一医院冯金洲、山西医科大学第一医院孟华星、唐都医院郭俊、广州市第一人民医院汪鸿浩、郑州大学第一附属医院刘洪波以及德国Charité – Universitätsmedizin Berlin大学Friedemann Paul等提供了多发性硬化患者的临床资料和样本;以及贺文艳、史凯斌、李敏淑和金薇娜等京津神经免疫中心(Beijing-Tianjin Center for Neuroinflammation, BTCN)许多成员的协同攻关。该项目由国家自然科学基金等多项基金资助。
文章链接:https://www.science.org/doi/10.1126/science.adq1177
