学术动态
刘志红团队《Nature》发现PLD4基因功能缺失性突变导致人类SLE并揭示其致病机制
作者:张昌明 来源自:中国免疫学会 点击数:4721 发布时间:2025-12-04
2025年11月13日,东部战区总医院国家肾脏疾病临床医学研究中心刘志红团队在《Nature》杂志发表题为“Loss-of-function mutations in PLD4 lead to systemic lupus erythematosus”的研究论文,首次揭示PLD4基因功能缺失性突变可导致人类系统性红斑狼疮(SLE);系统解析了PLD4突变导致其核酸外切酶活性降低,激活Toll样受体7(TLR7)和TLR9通路及其下游I型干扰素信号通路,驱动浆细胞样树突状细胞(pDCs)与浆细胞的细胞内在性扩增,从而介导SLE发生的核心致病机制;提出和验证了基于致病机制的精准干预策略。
系统性红斑狼疮(SLE)是一种高度异质性的自身免疫性疾病,常伴特异性自身抗体及多脏器损伤。刘志红团队长期致力于SLE致病基因解析及临床转化,已构建首个中国人群狼疮肾炎致病基因谱,发现包括DDX58在内的多个SLE致病基因,并解析致病机制,指导临床靶向治疗。此次PLD4基因的突破性发现,进一步推动了SLE精准诊疗的发展。
磷脂酶D家族成员4(PLD4)是一种定位于内溶酶体的5′核酸外切酶,能够切割单链RNA和单链DNA,从而限制TLR7和TLR9的过度激活。Pld4基因敲除小鼠会出现体重减轻、脾脏肿大、自身抗体增加和免疫复合物沉积等一系列自身免疫表型。但PLD4基因突变导致人类疾病尚未见报道。
研究团队在5个家系的5例狼疮肾炎患者中鉴定到PLD4基因的双等位基因突变。所有突变都定位于PLD4的催化结构域,均为罕见有害变异。酶活测定发现,PLD4突变导致其核酸外切酶活性显著降低。单细胞转录组测序和流式细胞术发现PLD4主要在树突状细胞(DCs)和单核细胞中高表达,而携带PLD4基因功能缺失性突变的患者DCs细胞中TLR7/9及其下游的I型干扰素通路激活最为显著。此外,在PLD4敲除的THP-1细胞系中证实了cGAS-STING通路的异常活化。研究结果表明TLR7/9及cGAS-STING通路是PLD4功能缺失调控的两条核心致病通路。
为揭示PLD4基因功能缺失性突变导致SLE的致病机制及效应免疫细胞群,研究团队构建了Pld4基因敲除小鼠模型。结果显示,Pld4缺陷小鼠表现出与人类患者高度一致的狼疮肾炎表型,包括体重减轻、脾肿大、自身抗体升高及肾脏免疫复合物沉积等。值得注意的是,肾脏是Pld4缺陷受累最显著的器官,这与人类狼疮肾炎的表型相吻合。进一步观察发现Pld4基因敲除小鼠肾脏中浆细胞样树突状细胞(pDCs)及浆细胞显著增多。更重要的是,通过混合骨髓嵌合体小鼠模型,研究团队证实pDCs和浆细胞的异常扩增是PLD4基因的细胞内在作用,是致病的关键效应细胞。
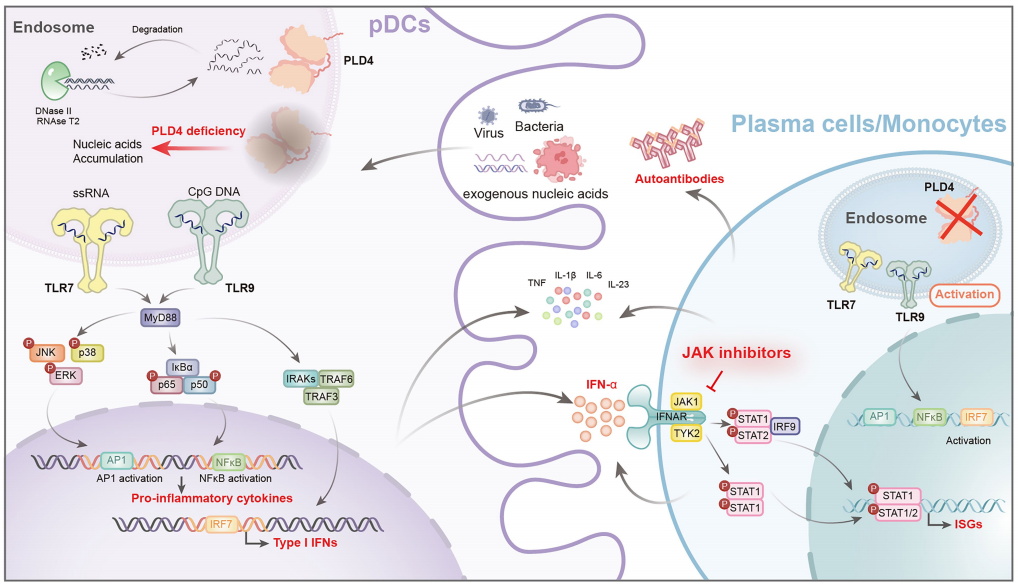
基于对致病机制的深刻理解,研究团队探索了靶向干预策略。考虑到PLD4基因功能缺失性突变模型中异常上调的I型干扰素信号通路,团队采用JAK抑制剂巴瑞替尼进行干预。结果显示,该治疗可显著缓解Pld4缺陷小鼠体重下降、脾肿大、自身抗体产生、免疫复合物沉积及组织炎症等自身免疫表型。尤为重要的是,巴瑞替尼在患者来源的PBMCs中同样能有效抑制I型干扰素通路的过度激活,为携带PLD4基因功能缺失性突变的SLE患者提供了潜在的精准治疗选择。
综上所述,该研究首次证实了PLD4基因功能缺失性突变可导致人类SLE,凸显了核酸稳态失调在SLE发生中的关键作用;揭示了SLE诊疗过程中“致病基因—核心通路—效应细胞—靶向干预”的全景图,为SLE这类复杂疾病的精准诊疗提供了新的路径和范式。由于PLD4—TLR7/9轴驱动的SLE与多种自身炎症性疾病具有相似性,且全基因组关联研究显示PLD4还与多种自身免疫性疾病相关;因此本研究提供的遗传学和机制性见解,也为更广泛地免疫性疾病发病机制的探索和治疗提供了理论依据。同时,本研究验证了靶向I型干扰素效应通路的JAK抑制剂对Pld4缺陷小鼠及患者来源的细胞均具有良好的治疗作用,为开展靶向核心致病通路和关键效应细胞的SLE个体化治疗提供了重要依据。而PLD4致病基因筛查有望成为未确诊SLE患者的标准化检测手段,以识别可能从PLD4靶向治疗中获益的群体。
东部战区总医院国家肾脏疾病临床医学研究中心刘志红院士,浙江大学良渚实验室俞晓敏研究员、周青教授为该论文共同通讯作者。浙江大学良渚实验室博士后王钦涛,博士生朱泓昊、孙相威,东部战区总医院国家肾脏疾病临床医学研究中心研究员张昌明,浙江大学良渚实验室博士生马双悦为该论文共同第一作者。该研究获国家自然科学基金、国家重点研发计划等项目支持。
论文链接:https://www.nature.com/articles/s41586-025-09513-x
系统性红斑狼疮(SLE)是一种高度异质性的自身免疫性疾病,常伴特异性自身抗体及多脏器损伤。刘志红团队长期致力于SLE致病基因解析及临床转化,已构建首个中国人群狼疮肾炎致病基因谱,发现包括DDX58在内的多个SLE致病基因,并解析致病机制,指导临床靶向治疗。此次PLD4基因的突破性发现,进一步推动了SLE精准诊疗的发展。
磷脂酶D家族成员4(PLD4)是一种定位于内溶酶体的5′核酸外切酶,能够切割单链RNA和单链DNA,从而限制TLR7和TLR9的过度激活。Pld4基因敲除小鼠会出现体重减轻、脾脏肿大、自身抗体增加和免疫复合物沉积等一系列自身免疫表型。但PLD4基因突变导致人类疾病尚未见报道。
研究团队在5个家系的5例狼疮肾炎患者中鉴定到PLD4基因的双等位基因突变。所有突变都定位于PLD4的催化结构域,均为罕见有害变异。酶活测定发现,PLD4突变导致其核酸外切酶活性显著降低。单细胞转录组测序和流式细胞术发现PLD4主要在树突状细胞(DCs)和单核细胞中高表达,而携带PLD4基因功能缺失性突变的患者DCs细胞中TLR7/9及其下游的I型干扰素通路激活最为显著。此外,在PLD4敲除的THP-1细胞系中证实了cGAS-STING通路的异常活化。研究结果表明TLR7/9及cGAS-STING通路是PLD4功能缺失调控的两条核心致病通路。
为揭示PLD4基因功能缺失性突变导致SLE的致病机制及效应免疫细胞群,研究团队构建了Pld4基因敲除小鼠模型。结果显示,Pld4缺陷小鼠表现出与人类患者高度一致的狼疮肾炎表型,包括体重减轻、脾肿大、自身抗体升高及肾脏免疫复合物沉积等。值得注意的是,肾脏是Pld4缺陷受累最显著的器官,这与人类狼疮肾炎的表型相吻合。进一步观察发现Pld4基因敲除小鼠肾脏中浆细胞样树突状细胞(pDCs)及浆细胞显著增多。更重要的是,通过混合骨髓嵌合体小鼠模型,研究团队证实pDCs和浆细胞的异常扩增是PLD4基因的细胞内在作用,是致病的关键效应细胞。

基于对致病机制的深刻理解,研究团队探索了靶向干预策略。考虑到PLD4基因功能缺失性突变模型中异常上调的I型干扰素信号通路,团队采用JAK抑制剂巴瑞替尼进行干预。结果显示,该治疗可显著缓解Pld4缺陷小鼠体重下降、脾肿大、自身抗体产生、免疫复合物沉积及组织炎症等自身免疫表型。尤为重要的是,巴瑞替尼在患者来源的PBMCs中同样能有效抑制I型干扰素通路的过度激活,为携带PLD4基因功能缺失性突变的SLE患者提供了潜在的精准治疗选择。
综上所述,该研究首次证实了PLD4基因功能缺失性突变可导致人类SLE,凸显了核酸稳态失调在SLE发生中的关键作用;揭示了SLE诊疗过程中“致病基因—核心通路—效应细胞—靶向干预”的全景图,为SLE这类复杂疾病的精准诊疗提供了新的路径和范式。由于PLD4—TLR7/9轴驱动的SLE与多种自身炎症性疾病具有相似性,且全基因组关联研究显示PLD4还与多种自身免疫性疾病相关;因此本研究提供的遗传学和机制性见解,也为更广泛地免疫性疾病发病机制的探索和治疗提供了理论依据。同时,本研究验证了靶向I型干扰素效应通路的JAK抑制剂对Pld4缺陷小鼠及患者来源的细胞均具有良好的治疗作用,为开展靶向核心致病通路和关键效应细胞的SLE个体化治疗提供了重要依据。而PLD4致病基因筛查有望成为未确诊SLE患者的标准化检测手段,以识别可能从PLD4靶向治疗中获益的群体。
东部战区总医院国家肾脏疾病临床医学研究中心刘志红院士,浙江大学良渚实验室俞晓敏研究员、周青教授为该论文共同通讯作者。浙江大学良渚实验室博士后王钦涛,博士生朱泓昊、孙相威,东部战区总医院国家肾脏疾病临床医学研究中心研究员张昌明,浙江大学良渚实验室博士生马双悦为该论文共同第一作者。该研究获国家自然科学基金、国家重点研发计划等项目支持。
论文链接:https://www.nature.com/articles/s41586-025-09513-x
