学术动态
宋尔卫/陈嘉宁团队《Nat Immunol》发现选择性激活cGAS-STING的特征性肿瘤DNA片段并揭示其与cGAS的新结合位点
作者:陈嘉宁 来源自:中国免疫学会 点击数:5061 发布时间:2025-12-02
2025 年 9 月 29 日,中山大学孙逸仙纪念医院宋尔卫教授、陈嘉宁教授团队在《Nature Immunology》在线发表了题为 “Chemotherapy-induced CA-repeat DNA fragments in breast cancer trigger antitumor immune responses”的研究论文。该研究首次从肿瘤基因组稳定性变化的角度系统阐明,化疗导致肿瘤细胞释放出不同性质的 DNA 片段,其是否富含 CA 重复序列直接决定了乳腺癌患者在化疗后呈现免疫促进或免疫抑制效应的方向。这一发现为长期困扰临床的化疗“双刃剑效应”提供了新的理论解释,并为乳腺癌免疫分型、疗效预测和联合免疫治疗策略的优化提供了坚实基础。
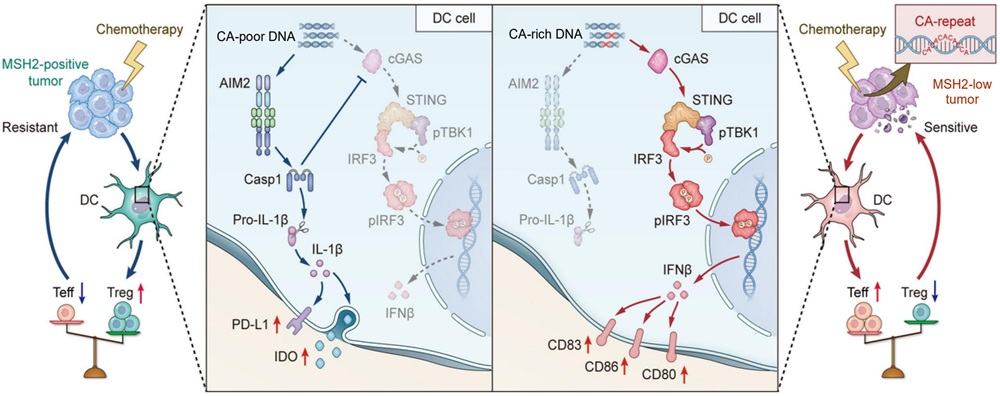
乳腺癌化疗过程中出现的免疫效应差异一直是临床实践中的关键难题。既往研究虽提示肿瘤细胞死亡后释放的损伤相关分子模式(DAMPs)参与调控,尤其是其中的 DNA 片段可能具有重要作用,但不同 DNA 片段如何塑造截然不同的免疫微环境仍缺乏明确机制。研究团队通过对接受蒽环类化疗的乳腺癌患者进行系统分析发现,患者可分为免疫促进型(IP)和免疫抑制型(IS)两大类,其核心差别正来源于化疗后肿瘤细胞释放的 DNA 片段性质不同:IP 表型患者肿瘤组织中富含 CA 重复序列的 DNA(CA-rich DNA)明显增多,而 IS 表型则以缺乏 CA 序列的 DNA(CA-poor DNA)为主。
进一步的机制研究发现,CA-rich DNA 与cGAS形成新的结合位点,两者高亲和力互作诱导液–液相分离形成生物分子凝聚体,从而抑制了DNA与免疫抑制型感受器AIM2的互作。通过这一分子互作模式的精准调控,一方面促进了cGAS–STING 信号通路的高度激活,促发 I 型干扰素效应,从而诱导树突状细胞成熟并增强 CD8⁺ T 细胞的活化与浸润;另一方面,CA-rich DNA 与AIM2结合受限抑制了炎症小体的激活,从而抑制了 PD-L1、IDO 等免疫抑制分子上调;综合以上效应,化疗后CA-rich DNA富集程度高的肿瘤表现出显著的免疫激活表型。这一“CA-rich 与 CA-poor DNA 双通路决定免疫命运”的发现揭示了化疗后免疫效应差异的分子基础。
该研究通过临床样本分析、动物模型实验和功能学验证构建了完整的证据链。临床数据表明,乳腺癌患者化疗后肿瘤内 CA-rich DNA 含量与免疫激活程度及化疗疗效呈显著正相关;动物实验进一步证实,携带 CA-rich DNA 的乳腺癌小鼠在化疗后具有更高水平的 T 细胞浸润和更强的肿瘤生长抑制;功能学研究亦显示,人工合成的 CA-rich DNA 可作为有效的疫苗佐剂显著增强抗肿瘤免疫反应,为相关治疗策略的临床转化提供了全新方向。
本研究从临床出发,通过深入的机制探索来回答化疗免疫效应差异根源这一关键科学问题,不仅填补了化疗“双刃剑效应”背后的理论空白,也为乳腺癌精准治疗提供了新的分型依据和预测指标,特别是 CA-rich DNA 在免疫激活和疗效预测中的潜在价值,为未来联合 CA-rich DNA 佐剂的免疫治疗策略奠定了重要基础。
中山大学孙逸仙纪念医院陈嘉宁副研究员、宋尔卫教授为论文通讯作者,博士生张小倩、黄鹏翰、陈惠萍、张超群为论文共同第一作者。该研究获国家重点研发计划、国家自然科学基金的资助。
原文链接:https://www.nature.com/articles/s41590-025-02289-2
乳腺癌化疗过程中出现的免疫效应差异一直是临床实践中的关键难题。既往研究虽提示肿瘤细胞死亡后释放的损伤相关分子模式(DAMPs)参与调控,尤其是其中的 DNA 片段可能具有重要作用,但不同 DNA 片段如何塑造截然不同的免疫微环境仍缺乏明确机制。研究团队通过对接受蒽环类化疗的乳腺癌患者进行系统分析发现,患者可分为免疫促进型(IP)和免疫抑制型(IS)两大类,其核心差别正来源于化疗后肿瘤细胞释放的 DNA 片段性质不同:IP 表型患者肿瘤组织中富含 CA 重复序列的 DNA(CA-rich DNA)明显增多,而 IS 表型则以缺乏 CA 序列的 DNA(CA-poor DNA)为主。
进一步的机制研究发现,CA-rich DNA 与cGAS形成新的结合位点,两者高亲和力互作诱导液–液相分离形成生物分子凝聚体,从而抑制了DNA与免疫抑制型感受器AIM2的互作。通过这一分子互作模式的精准调控,一方面促进了cGAS–STING 信号通路的高度激活,促发 I 型干扰素效应,从而诱导树突状细胞成熟并增强 CD8⁺ T 细胞的活化与浸润;另一方面,CA-rich DNA 与AIM2结合受限抑制了炎症小体的激活,从而抑制了 PD-L1、IDO 等免疫抑制分子上调;综合以上效应,化疗后CA-rich DNA富集程度高的肿瘤表现出显著的免疫激活表型。这一“CA-rich 与 CA-poor DNA 双通路决定免疫命运”的发现揭示了化疗后免疫效应差异的分子基础。

该研究通过临床样本分析、动物模型实验和功能学验证构建了完整的证据链。临床数据表明,乳腺癌患者化疗后肿瘤内 CA-rich DNA 含量与免疫激活程度及化疗疗效呈显著正相关;动物实验进一步证实,携带 CA-rich DNA 的乳腺癌小鼠在化疗后具有更高水平的 T 细胞浸润和更强的肿瘤生长抑制;功能学研究亦显示,人工合成的 CA-rich DNA 可作为有效的疫苗佐剂显著增强抗肿瘤免疫反应,为相关治疗策略的临床转化提供了全新方向。
本研究从临床出发,通过深入的机制探索来回答化疗免疫效应差异根源这一关键科学问题,不仅填补了化疗“双刃剑效应”背后的理论空白,也为乳腺癌精准治疗提供了新的分型依据和预测指标,特别是 CA-rich DNA 在免疫激活和疗效预测中的潜在价值,为未来联合 CA-rich DNA 佐剂的免疫治疗策略奠定了重要基础。
中山大学孙逸仙纪念医院陈嘉宁副研究员、宋尔卫教授为论文通讯作者,博士生张小倩、黄鹏翰、陈惠萍、张超群为论文共同第一作者。该研究获国家重点研发计划、国家自然科学基金的资助。
原文链接:https://www.nature.com/articles/s41590-025-02289-2
