学术动态
高庆蕾、马丁团队揭示卵巢癌精准治疗新方向——靶向效应调节性T细胞(eTreg)
作者:高庆蕾 来源自:中国免疫学会 点击数:10700 发布时间:2024-11-29
卵巢癌号称女性的“沉默杀手”,在女性恶性肿瘤中病死率居首位。尽管近年来随着新型分子靶向药物和免疫治疗的发展为诸多恶性肿瘤如肺癌、肝癌和淋巴瘤等带来了希望,但晚期卵巢癌5年生存率仍长期徘徊在30%。目前,晚期不可切的新诊断卵巢癌标准治疗方案仍然是含铂新辅助化疗加手术。以铂类为主的新辅助化疗存在早期治疗响应较高,但后期易耐药的问题,最终并未改善患者预后。基因组的高度不稳定是卵巢癌尤其是最难治的高级别浆液性卵巢癌的分子特征,常伴有BRCA1/2突变,导致同源重组修复缺陷(HRD),同时也为基于合成致死原理的PARP抑制剂治疗带来新的契机。目前,尽管PARP抑制剂已成功应用于包括卵巢癌、乳腺癌在内的多种肿瘤临床治疗,然而影响PARP抑制剂治疗反应性的关键微环境因素是什么,HRD相较同源重组修复完整(HRP)肿瘤免疫微环境又有何差异以及治疗如何重塑免疫微环境等重要临床和科学问题仍然悬而未决。
2024年9月5日,华中科技大学同济医学院附属同济医院马丁院士与高庆蕾教授团队联合美国M.D. Anderson癌症中心梁晗教授团队共同在国际顶级期刊《Cell》上正式发表了题为“Neoadjuvant PARPi or Chemotherapy in Ovarian Cancer Informs Targeting Effector Treg Cells for Homologous-Recombination-Deficient Tumors”的研究论文。这项研究首次基于前瞻性临床试验的多组学数据揭示了HRD和HRP卵巢癌的肿瘤微环境差异,阐明了PARP抑制剂(Niraparib,尼拉帕利)及化疗如何重塑肿瘤微环境,并为卵巢癌这类对靶向PD1/PD-L1疗效欠佳的“冷肿瘤”提供了免疫治疗新靶点和联合用药方案。
该研究中,同济医院高庆蕾教授团队开创性的发起了一项新辅助PARP抑制剂尼拉帕利口服单药治疗HRD晚期高级别浆液性卵巢癌的前瞻性、多中心、Ⅱ期临床试验(NANT, NCT04507841),探讨尼拉帕利在新辅助阶段的疗效和安全性。该临床试验为全面深入解析HRD与HRP卵巢癌肿瘤微环境差异及PARP抑制剂治疗如何重塑肿瘤微环境的研究奠定了坚实基础。
研究基于NANT临床试验得天独厚的优势,收集尼拉帕利单药治疗和含铂化疗前后配对的卵巢癌组织和血液标本,并通过临床HRD检测,单细胞转录组测序,单细胞T淋巴细胞受体序列测序,荧光多色免疫组化和多色流式探究发现:1)HRD阳性卵巢癌的免疫微环境相对活化,增殖型和IFN反应性CD4/8+ T淋巴细胞浸润比例增高;2)IFN反应性肿瘤细胞比例与eTreg比例正相关,其机制与肿瘤细胞中IFN-MHCⅡ通路相关;3)HRD阳性肿瘤免疫状态受eTreg负性调控,而尼拉帕利和铂类药物化疗都能显著逆转该负性调控,导致肿瘤整体负荷下降(CA125水平降低)。
为探讨联合靶向eTreg能否增敏尼拉帕利治疗,团队构建了多种小鼠HRD肿瘤模型进行验证。CCR8是eTreg的特异性标志物之一。研究团队应用再鼎医药(上海)有限公司提供的人源化CCR8单克隆抗体(ZL-1218)靶向清除eTreg。在CCR8人源化小鼠原位荷载HRD卵巢癌ID8模型中,靶向eTreg联合尼拉帕利的抑瘤效应显著优于尼拉帕利单药治疗,且治疗效应与eTreg比例下调相关,这一结论在小鼠HRD乳腺癌模型中同样得到验证。同时,CD25单克隆抗体清除Treg也能增强尼拉帕利的抑瘤效应。因此,该研究证实了靶向eTreg与尼拉帕利的联合抑瘤效应,为卵巢癌精准治疗提供了新的靶向免疫治疗方案。
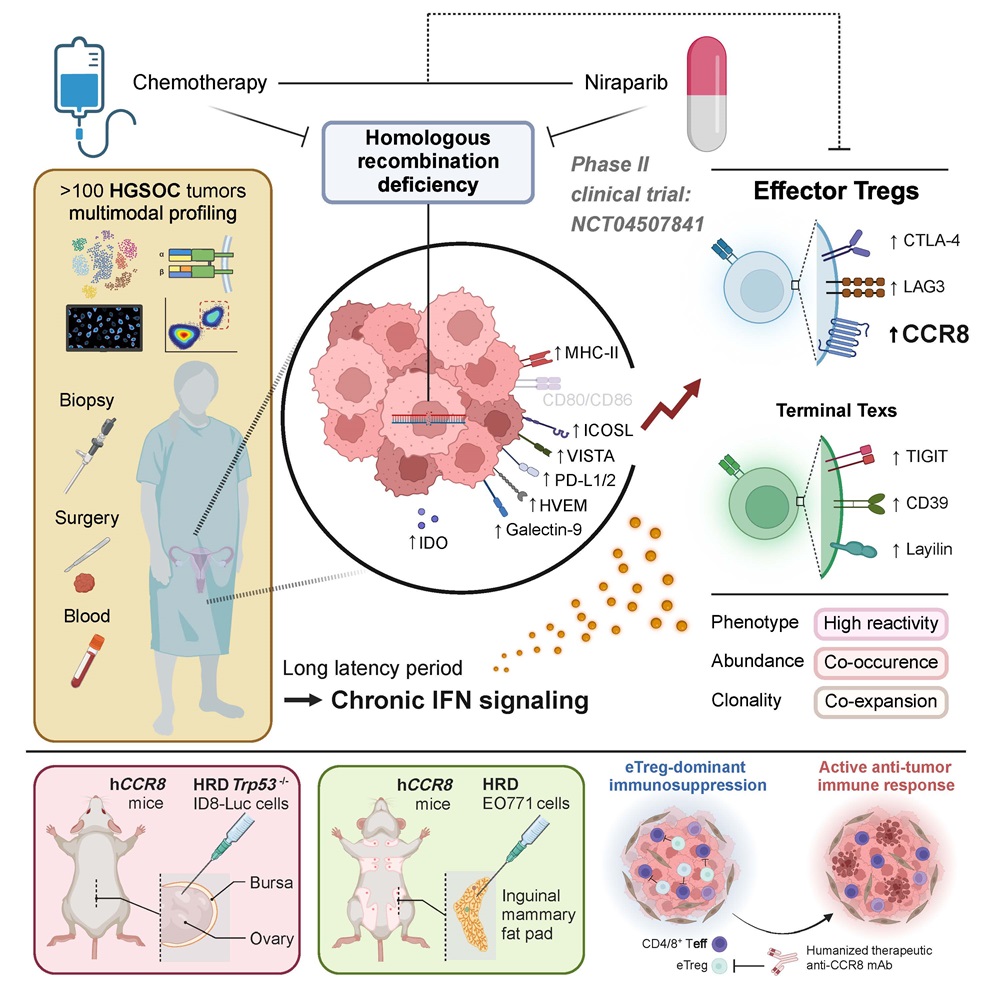
PARP抑制剂全球应用于临床已有十年,研究首次从临床角度解析了PARP抑制剂如何重塑卵巢癌微环境,发现了卵巢癌免疫治疗的新靶点eTreg,为未来卵巢癌的精准治疗和微环境研究开辟了新的方向。
华中科技大学同济医学院附属同济医院交流学习博士、MD Anderson癌症中心博士研究生罗伊凯,华中科技大学同济医学院附属同济医院助理研究员夏宇,副教授刘眈,武汉市中心医院副主任医师李雄,同济医院博士研究生李华裔,博士后刘家豪,博士研究生周东晨以及普瑞基准科技(北京)有限公司董宇博士为该论文共同第一作者。同济医院高庆蕾教授,美国MD Anderson癌症中心梁晗教授,同济医院方勇教授和马丁院士为该论文共同通讯作者。同时,该成果还受到再鼎医药(上海)有限公司,同济医院兰培祥教授,同济医学院杨想平教授,UCSF彭方略博士和Broad研究所陈则宇博士等大力支持和帮助。
原文链接:https://www.sciencedirect.com/science/article/pii/S0092867424006536
2024年9月5日,华中科技大学同济医学院附属同济医院马丁院士与高庆蕾教授团队联合美国M.D. Anderson癌症中心梁晗教授团队共同在国际顶级期刊《Cell》上正式发表了题为“Neoadjuvant PARPi or Chemotherapy in Ovarian Cancer Informs Targeting Effector Treg Cells for Homologous-Recombination-Deficient Tumors”的研究论文。这项研究首次基于前瞻性临床试验的多组学数据揭示了HRD和HRP卵巢癌的肿瘤微环境差异,阐明了PARP抑制剂(Niraparib,尼拉帕利)及化疗如何重塑肿瘤微环境,并为卵巢癌这类对靶向PD1/PD-L1疗效欠佳的“冷肿瘤”提供了免疫治疗新靶点和联合用药方案。
该研究中,同济医院高庆蕾教授团队开创性的发起了一项新辅助PARP抑制剂尼拉帕利口服单药治疗HRD晚期高级别浆液性卵巢癌的前瞻性、多中心、Ⅱ期临床试验(NANT, NCT04507841),探讨尼拉帕利在新辅助阶段的疗效和安全性。该临床试验为全面深入解析HRD与HRP卵巢癌肿瘤微环境差异及PARP抑制剂治疗如何重塑肿瘤微环境的研究奠定了坚实基础。
研究基于NANT临床试验得天独厚的优势,收集尼拉帕利单药治疗和含铂化疗前后配对的卵巢癌组织和血液标本,并通过临床HRD检测,单细胞转录组测序,单细胞T淋巴细胞受体序列测序,荧光多色免疫组化和多色流式探究发现:1)HRD阳性卵巢癌的免疫微环境相对活化,增殖型和IFN反应性CD4/8+ T淋巴细胞浸润比例增高;2)IFN反应性肿瘤细胞比例与eTreg比例正相关,其机制与肿瘤细胞中IFN-MHCⅡ通路相关;3)HRD阳性肿瘤免疫状态受eTreg负性调控,而尼拉帕利和铂类药物化疗都能显著逆转该负性调控,导致肿瘤整体负荷下降(CA125水平降低)。
为探讨联合靶向eTreg能否增敏尼拉帕利治疗,团队构建了多种小鼠HRD肿瘤模型进行验证。CCR8是eTreg的特异性标志物之一。研究团队应用再鼎医药(上海)有限公司提供的人源化CCR8单克隆抗体(ZL-1218)靶向清除eTreg。在CCR8人源化小鼠原位荷载HRD卵巢癌ID8模型中,靶向eTreg联合尼拉帕利的抑瘤效应显著优于尼拉帕利单药治疗,且治疗效应与eTreg比例下调相关,这一结论在小鼠HRD乳腺癌模型中同样得到验证。同时,CD25单克隆抗体清除Treg也能增强尼拉帕利的抑瘤效应。因此,该研究证实了靶向eTreg与尼拉帕利的联合抑瘤效应,为卵巢癌精准治疗提供了新的靶向免疫治疗方案。

PARP抑制剂全球应用于临床已有十年,研究首次从临床角度解析了PARP抑制剂如何重塑卵巢癌微环境,发现了卵巢癌免疫治疗的新靶点eTreg,为未来卵巢癌的精准治疗和微环境研究开辟了新的方向。
华中科技大学同济医学院附属同济医院交流学习博士、MD Anderson癌症中心博士研究生罗伊凯,华中科技大学同济医学院附属同济医院助理研究员夏宇,副教授刘眈,武汉市中心医院副主任医师李雄,同济医院博士研究生李华裔,博士后刘家豪,博士研究生周东晨以及普瑞基准科技(北京)有限公司董宇博士为该论文共同第一作者。同济医院高庆蕾教授,美国MD Anderson癌症中心梁晗教授,同济医院方勇教授和马丁院士为该论文共同通讯作者。同时,该成果还受到再鼎医药(上海)有限公司,同济医院兰培祥教授,同济医学院杨想平教授,UCSF彭方略博士和Broad研究所陈则宇博士等大力支持和帮助。
原文链接:https://www.sciencedirect.com/science/article/pii/S0092867424006536
