学术动态
邝栋明团队揭示癌周交叉呈递触发致病性炎症促进肿瘤免疫治疗超进展的机制和治疗新策略
作者:邝栋明 来源自:中国免疫学会 点击数:6641 发布时间:2024-11-21
肿瘤反应性的细胞毒性T淋巴细胞(Cytotoxic T lymphocyte, CTL)是抗肿瘤免疫的关键细胞,其浸润水平通常被视为预测免疫检查点阻断(Immune checkpoint blockade, ICB)治疗是否有效的重要指标。然而,目前能够从ICB治疗中获益的肿瘤患者数量十分有限。值得注意的是,有相当一部分肿瘤组织中T细胞浸润丰富的患者依旧无法响应ICB治疗,甚至有部分患者在接受ICB治疗后出现疾病超进展的情况。这些临床治疗中的现象引发出一个重要思考,即CTL在肿瘤进展的过程中是否以及如何发挥致病性功能?更重要的问题是,这些CTL的致病性功能是否依赖其效应功能?
2024年11月14日,中山大学生命科学学院邝栋明/魏瑗研究团队在《Cancer Cell》杂志在线发表题为“Pericancerous cross-presentation to cytotoxic T lymphocytes impairs immunotherapeutic efficacy in hepatocellular carcinoma”的研究论文。该研究发现癌周巨噬细胞通过抗原交叉呈递介导肿瘤反应性CTL(CD103+ CTL)在癌周区域滞留,这些滞留的效应CD103+ CTL反过来激活巨噬细胞的致病性炎症,最终导致免疫治疗超进展。
在该项研究中,研究人员结合肝癌患者中T细胞单细胞测序、TCR测序和空间转录组等数据的分析,对肝癌中肿瘤反应性CTL的表型、空间分布和功能进行了全面解析研究。结果提示,肝癌中肿瘤反应性CTL主要呈现CD103+ 组织驻留效应表型,但其浸润水平竟然与肿瘤进展正相关。进一步分析显示,CD103+ CTL主要滞留在癌周区域,并且其在癌周和肿瘤内的分布比例可以有效提示患者对ICB治疗的响应性。因此,CD103+ CTL在肿瘤微环境中的空间分布决定了其功能特性。
进一步探究CD103+ CTL在癌周区域滞留的机制时,研究者发现这些细胞在肿瘤组织中的浸润主要依赖CXCR3趋化因子轴。有趣的是,肝癌中CXCR3配体主要由具有高抗原呈递潜能的癌周巨噬细胞表达。进一步分析显示,癌周巨噬细胞通过抗原交叉呈递激活CD103+ CTL的扩增和效应功能,该过程中CD103+ 效应CTL分泌的IFN-γ进一步增强巨噬细胞的活化和CXCR3配体的表达。此外,肿瘤细胞由于DNA的高度甲基化表达CXCR3配体的水平极低,导致肿瘤内源性招募CD103+ CTL的驱动力不足。在这两种机制共同作用下,CD103+ CTL无法有效进入肿瘤内部,反而大量滞留在癌周区域。有趣的是,经交叉呈递激活的CD103+ CTL通过“穿孔素-钙流”途径反过来激活癌周巨噬细胞的NLRP3炎症小体,促进IL-1β的释放及下游粒细胞募集和血管生成,最终导致肿瘤免疫治疗超进展。因此,癌周巨噬细胞交叉呈递介导的CD103+ CTL在癌周区域的滞留,不仅削弱了肿瘤内的抗肿瘤免疫,还将CD103+ CTL的效应反应转化为促肿瘤炎症反应。基于此,研究者提出联合靶向肿瘤细胞内源性表观遗传沉默和癌周巨噬细胞对CD103+ CTL滞留的治疗策略,不仅能够增强肿瘤内CD103+ CTL的浸润,还能削弱癌周巨噬细胞的促肿瘤炎症反应,进而有效抑制疾病超进展并显著提高ICB治疗疗效。
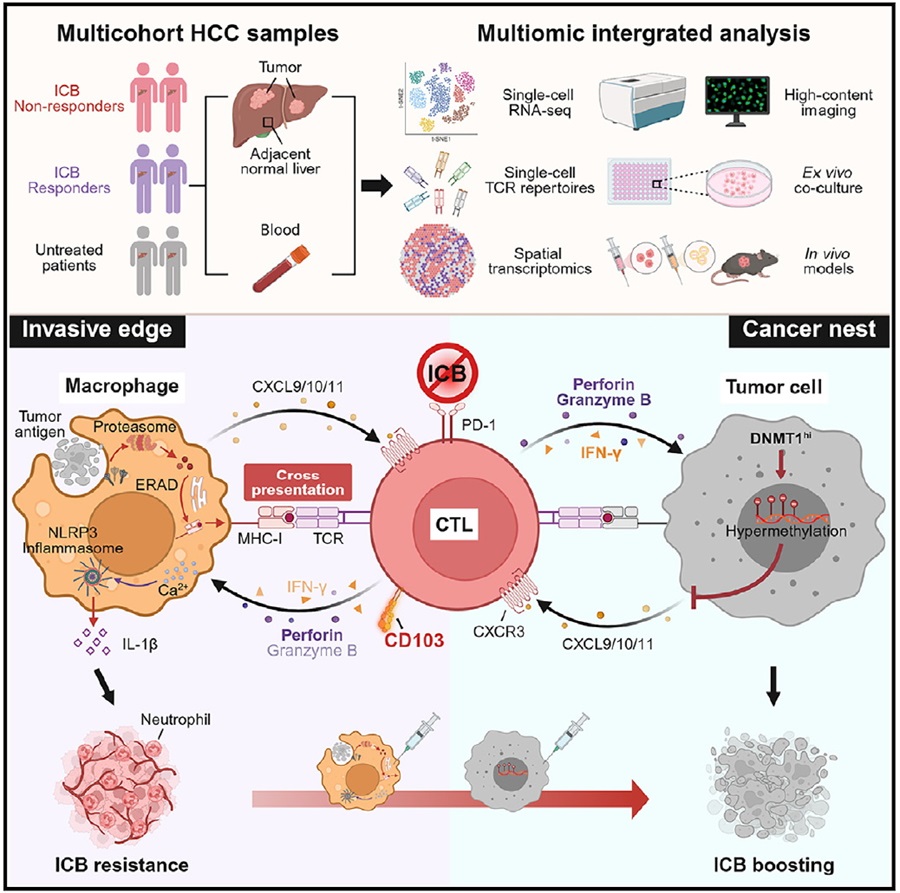
该研究拓展了肿瘤微环境中由巨噬细胞介导的抗原交叉呈递和CTL交互作用的认知,揭示了效应CTL在肿瘤免疫治疗超进展中的致病性功能。同时,发现靶向肿瘤微环境中CD103+ CTL的重分布能够削弱癌周的促肿瘤炎症反应并增强肿瘤内CTL的抗肿瘤效应,为ICB治疗增效提供了新的策略。
中山大学生命科学学院邝栋明教授和魏瑗副教授为该论文的通讯作者。中山大学生命科学学院黄春祥博士、中山大学肿瘤防治中心劳向明主任医师、中山大学生命科学学院王许燕博士为该论文的共同第一作者。中山大学肿瘤防治中心徐立教授、陈敏山教授,复旦大学附属中山医院高强教授和中国科学技术大学刘连新教授为本研究提供了重要支持。该研究受到科技部、国家自然基金委、广东省自然基金委和教育部的项目支持。
原文链接:https://doi.org/10.1016/j.ccell.2024.10.012
2024年11月14日,中山大学生命科学学院邝栋明/魏瑗研究团队在《Cancer Cell》杂志在线发表题为“Pericancerous cross-presentation to cytotoxic T lymphocytes impairs immunotherapeutic efficacy in hepatocellular carcinoma”的研究论文。该研究发现癌周巨噬细胞通过抗原交叉呈递介导肿瘤反应性CTL(CD103+ CTL)在癌周区域滞留,这些滞留的效应CD103+ CTL反过来激活巨噬细胞的致病性炎症,最终导致免疫治疗超进展。
在该项研究中,研究人员结合肝癌患者中T细胞单细胞测序、TCR测序和空间转录组等数据的分析,对肝癌中肿瘤反应性CTL的表型、空间分布和功能进行了全面解析研究。结果提示,肝癌中肿瘤反应性CTL主要呈现CD103+ 组织驻留效应表型,但其浸润水平竟然与肿瘤进展正相关。进一步分析显示,CD103+ CTL主要滞留在癌周区域,并且其在癌周和肿瘤内的分布比例可以有效提示患者对ICB治疗的响应性。因此,CD103+ CTL在肿瘤微环境中的空间分布决定了其功能特性。
进一步探究CD103+ CTL在癌周区域滞留的机制时,研究者发现这些细胞在肿瘤组织中的浸润主要依赖CXCR3趋化因子轴。有趣的是,肝癌中CXCR3配体主要由具有高抗原呈递潜能的癌周巨噬细胞表达。进一步分析显示,癌周巨噬细胞通过抗原交叉呈递激活CD103+ CTL的扩增和效应功能,该过程中CD103+ 效应CTL分泌的IFN-γ进一步增强巨噬细胞的活化和CXCR3配体的表达。此外,肿瘤细胞由于DNA的高度甲基化表达CXCR3配体的水平极低,导致肿瘤内源性招募CD103+ CTL的驱动力不足。在这两种机制共同作用下,CD103+ CTL无法有效进入肿瘤内部,反而大量滞留在癌周区域。有趣的是,经交叉呈递激活的CD103+ CTL通过“穿孔素-钙流”途径反过来激活癌周巨噬细胞的NLRP3炎症小体,促进IL-1β的释放及下游粒细胞募集和血管生成,最终导致肿瘤免疫治疗超进展。因此,癌周巨噬细胞交叉呈递介导的CD103+ CTL在癌周区域的滞留,不仅削弱了肿瘤内的抗肿瘤免疫,还将CD103+ CTL的效应反应转化为促肿瘤炎症反应。基于此,研究者提出联合靶向肿瘤细胞内源性表观遗传沉默和癌周巨噬细胞对CD103+ CTL滞留的治疗策略,不仅能够增强肿瘤内CD103+ CTL的浸润,还能削弱癌周巨噬细胞的促肿瘤炎症反应,进而有效抑制疾病超进展并显著提高ICB治疗疗效。

该研究拓展了肿瘤微环境中由巨噬细胞介导的抗原交叉呈递和CTL交互作用的认知,揭示了效应CTL在肿瘤免疫治疗超进展中的致病性功能。同时,发现靶向肿瘤微环境中CD103+ CTL的重分布能够削弱癌周的促肿瘤炎症反应并增强肿瘤内CTL的抗肿瘤效应,为ICB治疗增效提供了新的策略。
中山大学生命科学学院邝栋明教授和魏瑗副教授为该论文的通讯作者。中山大学生命科学学院黄春祥博士、中山大学肿瘤防治中心劳向明主任医师、中山大学生命科学学院王许燕博士为该论文的共同第一作者。中山大学肿瘤防治中心徐立教授、陈敏山教授,复旦大学附属中山医院高强教授和中国科学技术大学刘连新教授为本研究提供了重要支持。该研究受到科技部、国家自然基金委、广东省自然基金委和教育部的项目支持。
原文链接:https://doi.org/10.1016/j.ccell.2024.10.012
