学术动态
曹雪涛团队CRISPR筛选发现克服乳腺癌免疫治疗耐药新靶点
作者:中国免疫学会 来源自:中国免疫学会 点击数:9739 发布时间:2024-12-16
免疫检查点阻断(immune checkpoint blockade, ICB)疗法显著改善了恶性肿瘤患者的预后。然而,多数癌症患者无法从ICB治疗中获益。破译ICB耐药机制,特别是肿瘤细胞内在因子介导的免疫逃逸,将有助于提高ICB疗效。三阴性乳腺癌(TNBC)是最具侵袭性的乳腺癌亚型,复发率高,预后差,对免疫治疗通常无反应。TNBC对免疫治疗耐药的机制复杂,包括抗原提呈受损导致的低免疫原性和免疫抑制分子升高(例如PD-L1)。靶向肿瘤内在因子增强肿瘤免疫原性,重编程肿瘤微环境(TME),尤其是CD8 T细胞,使“冷”肿瘤变为“热”肿瘤,是克服TNBC免疫治疗耐药的理想策略。但关于提高TNBC肿瘤细胞免疫原性的研究仍然有限,为了协同免疫治疗,有必要揭示增强肿瘤免疫原性的新的肿瘤内在因素。
2024年12月12日,曹雪涛院士团队在Cancer Cell期刊在线发表了题为“Inhibiting intracellular CD28 in cancer cells enhances antitumor immunity and overcomes anti-PD-1 resistance via targeting PD-L1”的研究论文,发现了癌细胞胞内 CD28 的存在,及其在抗肿瘤免疫与免疫治疗耐药中的作用。

体内全基因组CRISPR筛选已经发现了多种癌症中调节耐药性或免疫治疗敏感性的靶点,是此研究的有力工具。首先,作者在三阴性乳腺癌(TNBC)模型中运用小鼠慢病毒敲除文库,系统地识别出参与免疫逃逸的关键基因,其中癌细胞Cd28被确定为潜在介质。作者还通过蛋白质印迹、免疫荧光和RNA原位杂交等多种技术证实了癌细胞中CD28的存在。CD28在癌细胞中独特的细胞内和细胞质定位,有别于正常细胞,暗示了一种非常规功能。对翻译后修饰(如乙酰化)的探索揭示了CD28细胞定位的潜在调控机制。
进一步研究发现了Cd28在肿瘤细胞中促进免疫逃逸的非经典功能。在肿瘤细胞中敲除Cd28增加了I型常规树突状细胞(cDC1)和活化的肿瘤特异性CD8 T细胞的浸润,在体内,药理学诱导的Cd28敲低抑制了预先建立的肿瘤生长,克服了抗PD-1的耐药性。分子机制是,肿瘤细胞内的CD28可以直接与Cd274 mRNA结合,招募剪接因子SNRPB2进入细胞核以稳定Cd274 mRNA,进而促进肿瘤细胞的PD-L1表达并实现肿瘤免疫逃逸。
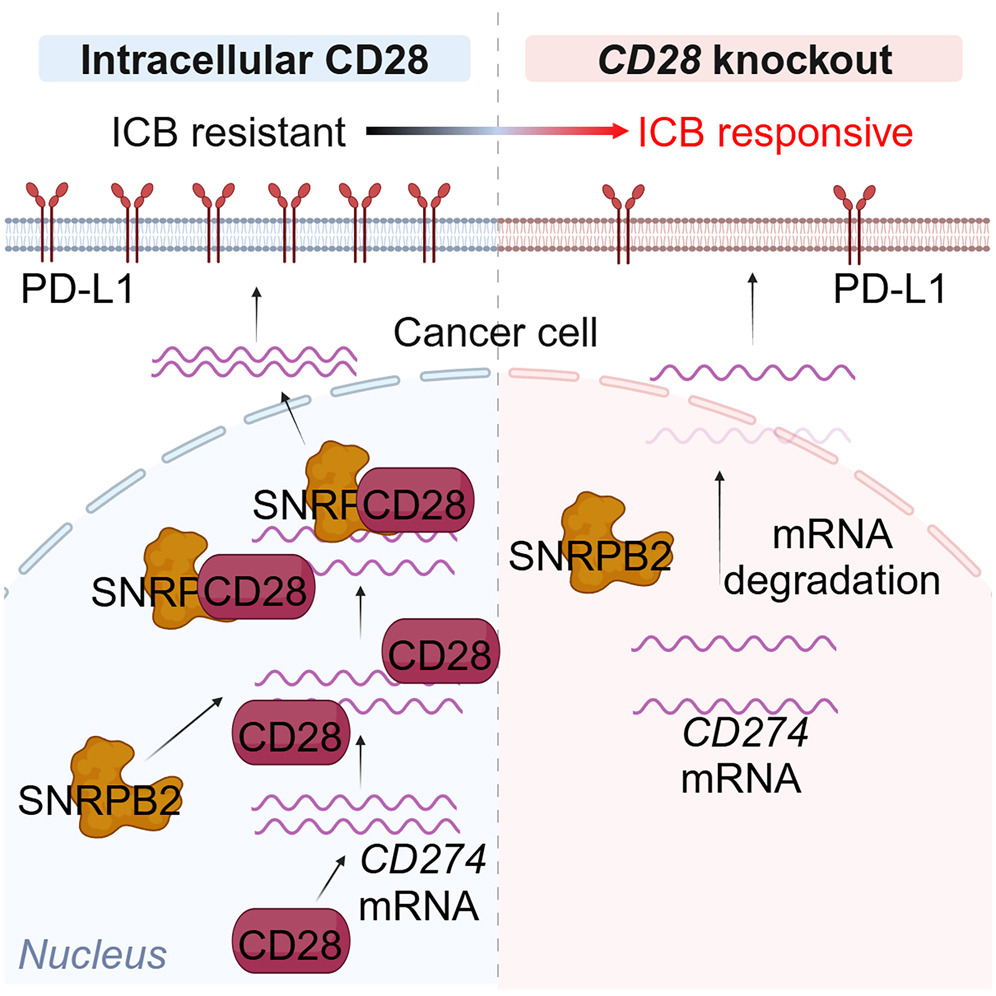
临床相关性方面,发现在人乳腺癌组织中,癌细胞高表达CD28与PD-L1表达增加、CD8 T细胞浸润减少和患者预后不良相关。对不同亚型和临床阶段的分析揭示了这些关联,为临床前发现提供了临床背景。癌细胞中确定的CD28-SNRPB2-PD-L1轴具有临床相关性,为增强乳腺癌和肺癌免疫治疗疗效提示了潜在治疗靶点。
这些结果表明,抑制肿瘤细胞胞内CD28,能够通过靶向PD-L1增强抗肿瘤免疫并克服抗PD-1耐药,为改善乳腺癌免疫治疗提供了一条潜在新途径。
本研究受到国家自然科学基金委员会基础科学中心项目(82388201)、中国医学科学院健康创新工程(2021-I2M-1-017)以及南开大学全国重点实验室项目(035-BB042411,035-9242000502)的支持。
原文链接:https://www.cell.com/cancer-cell/abstract/S1535-6108(24)00443-4
2024年12月12日,曹雪涛院士团队在Cancer Cell期刊在线发表了题为“Inhibiting intracellular CD28 in cancer cells enhances antitumor immunity and overcomes anti-PD-1 resistance via targeting PD-L1”的研究论文,发现了癌细胞胞内 CD28 的存在,及其在抗肿瘤免疫与免疫治疗耐药中的作用。

体内全基因组CRISPR筛选已经发现了多种癌症中调节耐药性或免疫治疗敏感性的靶点,是此研究的有力工具。首先,作者在三阴性乳腺癌(TNBC)模型中运用小鼠慢病毒敲除文库,系统地识别出参与免疫逃逸的关键基因,其中癌细胞Cd28被确定为潜在介质。作者还通过蛋白质印迹、免疫荧光和RNA原位杂交等多种技术证实了癌细胞中CD28的存在。CD28在癌细胞中独特的细胞内和细胞质定位,有别于正常细胞,暗示了一种非常规功能。对翻译后修饰(如乙酰化)的探索揭示了CD28细胞定位的潜在调控机制。
进一步研究发现了Cd28在肿瘤细胞中促进免疫逃逸的非经典功能。在肿瘤细胞中敲除Cd28增加了I型常规树突状细胞(cDC1)和活化的肿瘤特异性CD8 T细胞的浸润,在体内,药理学诱导的Cd28敲低抑制了预先建立的肿瘤生长,克服了抗PD-1的耐药性。分子机制是,肿瘤细胞内的CD28可以直接与Cd274 mRNA结合,招募剪接因子SNRPB2进入细胞核以稳定Cd274 mRNA,进而促进肿瘤细胞的PD-L1表达并实现肿瘤免疫逃逸。

临床相关性方面,发现在人乳腺癌组织中,癌细胞高表达CD28与PD-L1表达增加、CD8 T细胞浸润减少和患者预后不良相关。对不同亚型和临床阶段的分析揭示了这些关联,为临床前发现提供了临床背景。癌细胞中确定的CD28-SNRPB2-PD-L1轴具有临床相关性,为增强乳腺癌和肺癌免疫治疗疗效提示了潜在治疗靶点。
这些结果表明,抑制肿瘤细胞胞内CD28,能够通过靶向PD-L1增强抗肿瘤免疫并克服抗PD-1耐药,为改善乳腺癌免疫治疗提供了一条潜在新途径。
本研究受到国家自然科学基金委员会基础科学中心项目(82388201)、中国医学科学院健康创新工程(2021-I2M-1-017)以及南开大学全国重点实验室项目(035-BB042411,035-9242000502)的支持。
原文链接:https://www.cell.com/cancer-cell/abstract/S1535-6108(24)00443-4
