学术动态
清华大学胡小玉团队《Immunity》发文揭示肥大细胞新功能
作者:胡小玉 来源自:中国免疫学会 点击数:11804 发布时间:2024-06-14
与许多广受关注的免疫细胞相比,近年来肥大细胞在免疫学研究中相对被忽视。对肥大细胞功能的研究常常局限于传统范式,例如免疫学教科书和综述文章通常将肥大细胞的功能等同于IgE介导的脱颗粒。然而,肥大细胞在进化上早于最初的获得性免疫系统两亿多年,这表明它们必然具备与IgE无关的功能,这些功能可能是其存在的基本特性。
2024年4月12日,清华大学免疫学研究所胡小玉课题组在《Immunity》杂志上在线发表了一篇题为“Intraepithelial mast cells drive gasdermin C-mediated type 2 immunity”的研究论文。该论文研究了定植于肠道上皮的一种特殊肥大细胞群体,揭示了这些肥大细胞在二型免疫反应中的重要作用,详细阐述了它们与上皮细胞的相互作用,以及如何激活上皮细胞中的Gasdermin C蛋白,从而介导关键细胞因子IL-33的分泌。
早在1919年,一位德国病理学家已经在猫、狗和绵羊等动物的肠道上皮中观察到了嵌于上皮细胞间的肥大细胞。然而,这些定植于上皮的肥大细胞的功能一直不明。胡小玉课题组在研究二型免疫反应过程中,使用寄生虫感染模型,也观察到了这些上皮间肥大细胞(intraepithelial mast cells,IEMCs)。他们使用β7整合素等分子标记物,成功从肠道中分离出了IEMCs,并分析了它们的基因转录组和表观遗传特性,显示这些细胞可能积极参与细胞间相互作用。这些分子图谱分析结果与IEMCs在体内的定位一致,因此研究进一步聚焦于IEMCs与上皮细胞的互作。他们发现,IEMCs可以通过生成纳米微管,将特有的蛋白酶Mcpt1等物质传递给上皮细胞,从而实现直接相互作用。值得注意的是,这种相互作用不依赖于IgE,并且可以在仅含有IEMCs和上皮细胞的体外共培养体系中完全重构。
接下来一个关键问题是IEMCs传递给上皮细胞的物质发挥了怎样的生物学功能。经过深入研究,他们发现IEMCs可以介导肠道上皮细胞内Gasdermin C(Gsdmc)蛋白的切割和激活;在缺乏肥大细胞的小鼠中,Gsdmc在上皮细胞中无法被切割。在具体的分子机制研究中,他们纯化了IEMCs中特异性高表达的酶,与Gsdmc蛋白共同孵育后发现Mcpt1可以切割Gsdmc。他们使用Mcpt1敲除小鼠模型,发现Mcpt1缺失部分抑制了Gsdmc的切割。在免疫学功能方面,IEMCs介导的Gsdmc激活促使上皮细胞内二型免疫关键细胞因子IL-33释放到细胞外,激活ILC2,最终增强肠道内的二型免疫反应。这些结果揭示了至少一种体内具有切割Gsdmc活性的蛋白酶,并解释了Gsdmc在生理过程中被激活的机制。
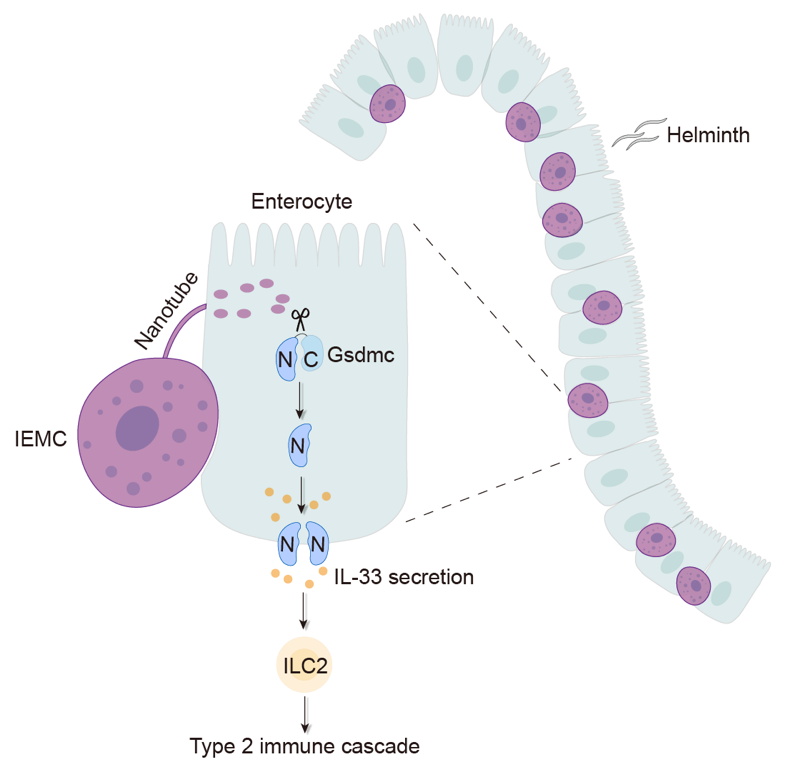
总的来说,这些结合了免疫机制与生化手段的研究揭示了肥大细胞的新作用方式,即IEMCs与上皮细胞的相互作用在肠道二型免疫反应中是不可或缺的一环。这项研究为肥大细胞及其相关的二型免疫反应机制研究提供了新的思路。目前发表的研究只是开端,进化了六亿多年的肥大细胞还有许多未知等待探索,利用现代先进技术重新认识和定义这类古老细胞势在必行,相信在不久的将来会带来更多惊喜。
本研究由胡小玉课题组与北京生命科学研究所邵峰课题组紧密合作完成。胡小玉教授为本文的通讯作者。胡小玉课题组博士后杨柳与邵峰课题组博士后何华斌为本文共同第一作者。该论文得到了来自清华大学生命科学学院/免疫学研究所的刘万里教授大力支持。该研究得到了科技部、国家自然科学基金委、清华大学-北京大学生命科学联合中心、清华大学免疫学研究所和广州实验室的资助。
原文链接:https://linkinghub.elsevier.com/retrieve/pii/S1074761324001389
2024年4月12日,清华大学免疫学研究所胡小玉课题组在《Immunity》杂志上在线发表了一篇题为“Intraepithelial mast cells drive gasdermin C-mediated type 2 immunity”的研究论文。该论文研究了定植于肠道上皮的一种特殊肥大细胞群体,揭示了这些肥大细胞在二型免疫反应中的重要作用,详细阐述了它们与上皮细胞的相互作用,以及如何激活上皮细胞中的Gasdermin C蛋白,从而介导关键细胞因子IL-33的分泌。
早在1919年,一位德国病理学家已经在猫、狗和绵羊等动物的肠道上皮中观察到了嵌于上皮细胞间的肥大细胞。然而,这些定植于上皮的肥大细胞的功能一直不明。胡小玉课题组在研究二型免疫反应过程中,使用寄生虫感染模型,也观察到了这些上皮间肥大细胞(intraepithelial mast cells,IEMCs)。他们使用β7整合素等分子标记物,成功从肠道中分离出了IEMCs,并分析了它们的基因转录组和表观遗传特性,显示这些细胞可能积极参与细胞间相互作用。这些分子图谱分析结果与IEMCs在体内的定位一致,因此研究进一步聚焦于IEMCs与上皮细胞的互作。他们发现,IEMCs可以通过生成纳米微管,将特有的蛋白酶Mcpt1等物质传递给上皮细胞,从而实现直接相互作用。值得注意的是,这种相互作用不依赖于IgE,并且可以在仅含有IEMCs和上皮细胞的体外共培养体系中完全重构。
接下来一个关键问题是IEMCs传递给上皮细胞的物质发挥了怎样的生物学功能。经过深入研究,他们发现IEMCs可以介导肠道上皮细胞内Gasdermin C(Gsdmc)蛋白的切割和激活;在缺乏肥大细胞的小鼠中,Gsdmc在上皮细胞中无法被切割。在具体的分子机制研究中,他们纯化了IEMCs中特异性高表达的酶,与Gsdmc蛋白共同孵育后发现Mcpt1可以切割Gsdmc。他们使用Mcpt1敲除小鼠模型,发现Mcpt1缺失部分抑制了Gsdmc的切割。在免疫学功能方面,IEMCs介导的Gsdmc激活促使上皮细胞内二型免疫关键细胞因子IL-33释放到细胞外,激活ILC2,最终增强肠道内的二型免疫反应。这些结果揭示了至少一种体内具有切割Gsdmc活性的蛋白酶,并解释了Gsdmc在生理过程中被激活的机制。

总的来说,这些结合了免疫机制与生化手段的研究揭示了肥大细胞的新作用方式,即IEMCs与上皮细胞的相互作用在肠道二型免疫反应中是不可或缺的一环。这项研究为肥大细胞及其相关的二型免疫反应机制研究提供了新的思路。目前发表的研究只是开端,进化了六亿多年的肥大细胞还有许多未知等待探索,利用现代先进技术重新认识和定义这类古老细胞势在必行,相信在不久的将来会带来更多惊喜。
本研究由胡小玉课题组与北京生命科学研究所邵峰课题组紧密合作完成。胡小玉教授为本文的通讯作者。胡小玉课题组博士后杨柳与邵峰课题组博士后何华斌为本文共同第一作者。该论文得到了来自清华大学生命科学学院/免疫学研究所的刘万里教授大力支持。该研究得到了科技部、国家自然科学基金委、清华大学-北京大学生命科学联合中心、清华大学免疫学研究所和广州实验室的资助。
原文链接:https://linkinghub.elsevier.com/retrieve/pii/S1074761324001389
