学术动态
复旦大学许杰团队《Cell》发文揭示CD3L1免疫检查点
作者:许杰 来源自:中国免疫学会 点击数:9119 发布时间:2024-05-15
免疫检查点阻断(ICB)的出现为临床肿瘤治疗带来深刻变革,但仍有大量患者对现有免疫治疗响应不佳,因此寻找有效的免疫治疗新靶点已成为全球学者十分重视的关键问题。在T细胞介导的抗肿瘤免疫应答过程中,T细胞受体(TCR)-CD3复合体扮演着核心且不可或缺的角色。以往的研究多聚焦于MHC这个激动型配体对TCR/CD3的作用,并在此基础上产生了工程化改造TCR/CD3的抗肿瘤疗法,包括TCR-T、CAR-T等药物。然而,关于TCR/CD3天然抑制型配体的研究罕有报道。
2024年4月12日,复旦大学生物医学研究院的许杰课题组在Cell杂志发表题为“ITPRIPL1 binds CD3ε to impede T-cell activation and enable tumor immune evasion”的研究论文,发现CD3的首个配体CD3L1(或 ITPRIPL1),并揭示CD3L1在肿瘤免疫逃逸与睾丸免疫豁免中的关键作用。
许杰团队最初关注到CD3L1这个功能从未被研究过的基因,首先是因为CD3L1与PD-L1在肿瘤中的表达呈现互斥,且CD3L1在PD-1/PD-L1阻断缺乏响应的肿瘤中高表达。与PD-L1表达在免疫豁免器官胎盘类似,CD3L1在另一种免疫豁免器官睾丸中表现出特异性的高表达。作者通过单细胞测序发现CD3L1对T细胞的抑制作用,进一步观察到小鼠被敲除CD3L1后睾丸出现显著的自身免疫反应,且肿瘤细胞缺失CD3L1的表达后被T细胞有效地杀伤,这些结果提示CD3L1可能通过抑制T细胞维持睾丸的免疫豁免和肿瘤免疫逃逸。
作者发现CD3L1与CD3E存在直接的物理结合,并通过后者产生对T细胞的抑制作用。在分子机制层面,CD3L1与CD3ε受体结合后,能够导致Nck持续结合到CD3ε的胞内域,这竞争性地抑制了Zap70的招募和磷酸化,从而在T细胞激活的初始阶段即“信号1”阶段抑制T细胞的激活,这与既往已知的PD-1/PD-L1等免疫检查点通路作用在T细胞激活中后期即“信号2”不同(如下图)。
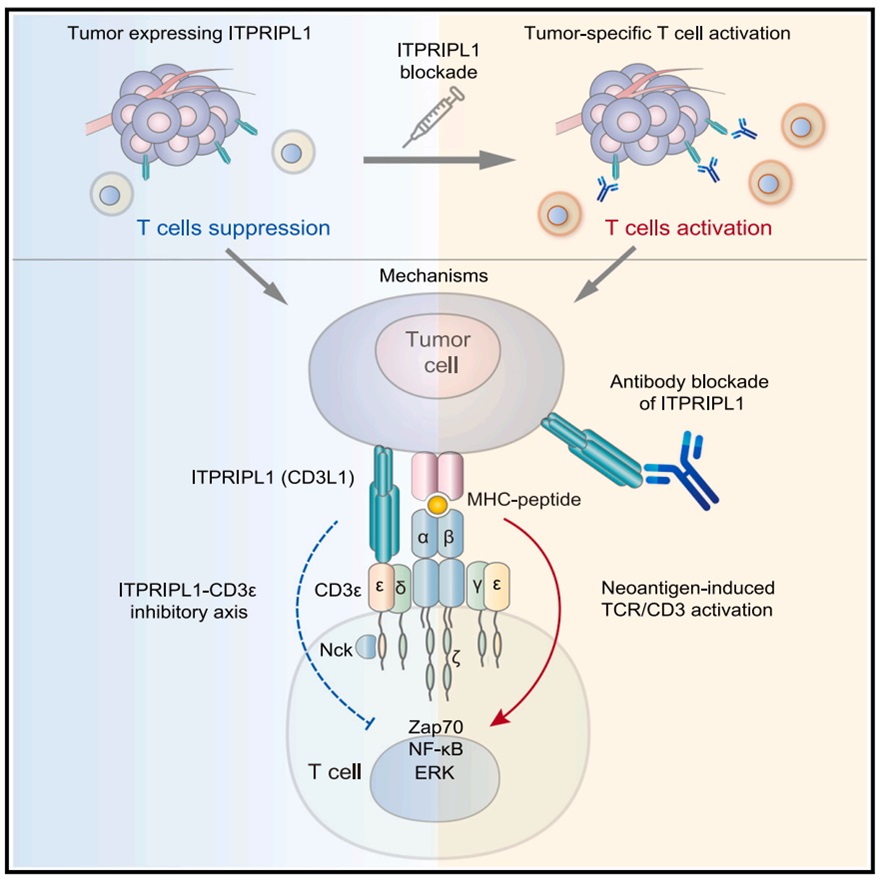
在既往对TCR/CD3受体复合物的研究中,通常认为仅TCR是受体,接受配体MHC的激活信号;而CD3因缺少天然配体而不被认为是受体,其工作方式仅是传递TCR的激活信号。本研究首次揭示了CD3天然配体的存在,这意味着TCR/CD3受体复合物的“主从关系”可能被改写,从以TCR为受体的“单极”调控方式,变为TCR和CD3都可以接受天然配体信号的“双极”工作方式。这个突破性的发现可能对肿瘤免疫药物的开发产生深远而积极的影响。
基于对CD3L1:CD3免疫检查点信号轴的发现,许杰团队开发了全新一类的检查点抑制剂CD3L1抗体,通过建立多个小鼠肿瘤模型,验证了CD3L1抗体在体内激活T细胞并抑制肿瘤生长的显著作用。为了进一步验证其治疗潜力,团队还将其应用于宠物自发肿瘤的治疗中。鉴于PD-1抗体在宠物肿瘤治疗中取得的显著疗效,这为CD3L1抗体在人类肿瘤治疗中的有效性提供了重要的参考,也为今后抗肿瘤药物的转化医学研究策略提供了新的思路。
目前,CD3L1抗体治疗肿瘤的临床试验已经顺利获得美国FDA和中国NMPA的新药临床研究(IND)许可,正处于I期临床研究阶段。以CD3L1为靶点的全新一类(first-in class)免疫检查点抑制剂的问世,不仅彰显了我国科学家的原始创新能力,更是依托单位大力推进科研成果转化而结出的硕果。复旦大学在项目的早期阶段就积极投入,致力于核心专利的打造,并稳妥推进知识产权向创新药物研发企业的授权转让,为项目的顺利融资、临床前与临床研究的推进奠定了坚实的基础。这标志着我国在生物医药领域在“从0到1”的靶点级别原始创新方面迈出了坚实的步伐。这一成果的取得,将为肿瘤免疫治疗领域带来新的希望,为更多患者带来福音。
文章链接:https://linkinghub.elsevier.com/retrieve/pii/S0092-8674(24)00310-6
2024年4月12日,复旦大学生物医学研究院的许杰课题组在Cell杂志发表题为“ITPRIPL1 binds CD3ε to impede T-cell activation and enable tumor immune evasion”的研究论文,发现CD3的首个配体CD3L1(或 ITPRIPL1),并揭示CD3L1在肿瘤免疫逃逸与睾丸免疫豁免中的关键作用。
许杰团队最初关注到CD3L1这个功能从未被研究过的基因,首先是因为CD3L1与PD-L1在肿瘤中的表达呈现互斥,且CD3L1在PD-1/PD-L1阻断缺乏响应的肿瘤中高表达。与PD-L1表达在免疫豁免器官胎盘类似,CD3L1在另一种免疫豁免器官睾丸中表现出特异性的高表达。作者通过单细胞测序发现CD3L1对T细胞的抑制作用,进一步观察到小鼠被敲除CD3L1后睾丸出现显著的自身免疫反应,且肿瘤细胞缺失CD3L1的表达后被T细胞有效地杀伤,这些结果提示CD3L1可能通过抑制T细胞维持睾丸的免疫豁免和肿瘤免疫逃逸。
作者发现CD3L1与CD3E存在直接的物理结合,并通过后者产生对T细胞的抑制作用。在分子机制层面,CD3L1与CD3ε受体结合后,能够导致Nck持续结合到CD3ε的胞内域,这竞争性地抑制了Zap70的招募和磷酸化,从而在T细胞激活的初始阶段即“信号1”阶段抑制T细胞的激活,这与既往已知的PD-1/PD-L1等免疫检查点通路作用在T细胞激活中后期即“信号2”不同(如下图)。

在既往对TCR/CD3受体复合物的研究中,通常认为仅TCR是受体,接受配体MHC的激活信号;而CD3因缺少天然配体而不被认为是受体,其工作方式仅是传递TCR的激活信号。本研究首次揭示了CD3天然配体的存在,这意味着TCR/CD3受体复合物的“主从关系”可能被改写,从以TCR为受体的“单极”调控方式,变为TCR和CD3都可以接受天然配体信号的“双极”工作方式。这个突破性的发现可能对肿瘤免疫药物的开发产生深远而积极的影响。
基于对CD3L1:CD3免疫检查点信号轴的发现,许杰团队开发了全新一类的检查点抑制剂CD3L1抗体,通过建立多个小鼠肿瘤模型,验证了CD3L1抗体在体内激活T细胞并抑制肿瘤生长的显著作用。为了进一步验证其治疗潜力,团队还将其应用于宠物自发肿瘤的治疗中。鉴于PD-1抗体在宠物肿瘤治疗中取得的显著疗效,这为CD3L1抗体在人类肿瘤治疗中的有效性提供了重要的参考,也为今后抗肿瘤药物的转化医学研究策略提供了新的思路。
目前,CD3L1抗体治疗肿瘤的临床试验已经顺利获得美国FDA和中国NMPA的新药临床研究(IND)许可,正处于I期临床研究阶段。以CD3L1为靶点的全新一类(first-in class)免疫检查点抑制剂的问世,不仅彰显了我国科学家的原始创新能力,更是依托单位大力推进科研成果转化而结出的硕果。复旦大学在项目的早期阶段就积极投入,致力于核心专利的打造,并稳妥推进知识产权向创新药物研发企业的授权转让,为项目的顺利融资、临床前与临床研究的推进奠定了坚实的基础。这标志着我国在生物医药领域在“从0到1”的靶点级别原始创新方面迈出了坚实的步伐。这一成果的取得,将为肿瘤免疫治疗领域带来新的希望,为更多患者带来福音。
文章链接:https://linkinghub.elsevier.com/retrieve/pii/S0092-8674(24)00310-6
