学术动态
王骥团队《Nature》发文研制新型疫苗佐剂破解抗原交叉递呈“最后一公里”难题
作者:蒋娟 来源自:中国免疫学会 点击数:11685 发布时间:2025-05-22
疫苗是传染病最经济和最有效的防治措施,也是肿瘤等慢病最具潜力的治疗手段之一。现有预防性疫苗还无法有效应对高变异病原体,而治疗性疫苗还无法根除慢性感染和肿瘤,突破其背后的共性免疫学问题是疫苗技术创新的源头。CD8+ T细胞是清除感染细胞、肿瘤细胞的主要效应细胞,且往往靶向保守表位,其高效诱导一直是广谱预防性疫苗和治疗性疫苗的目标,但长期受制于抗原交叉递呈的效率瓶颈。
抗原交叉递呈主要发生在树突状细胞(DC)中,需要经历抗原被摄取进入细胞质,到达内质网,随后被裁剪装载到MHC-I这一过程。既往研究主要聚焦于设计佐剂与递送系统将抗原投递到DC的细胞质中,激活其先天免疫通路,促进共刺激分子和细胞因子表达。然而,即使已有强效佐剂,CD8+ T细胞免疫反应的诱导仍不及预期。近期文献综述总结发现,临床研究中的肿瘤多肽疫苗所诱导的抗原特异性CD8+ T细胞免疫往往只占血液中总CD8+ T细胞的0.1%,远低于那些可诱导终身防护的活病毒疫苗(如黄热、天花)所能达到的10-20%的水平(Nat Rev Immunol. 2024 Mar;24(3):213-227)。
得益于无数研究团队数十年的努力,现有疫苗技术在抗原摄取和先天免疫通路激活方面的表现已非常优异,要进一步跨越与活病毒疫苗间的巨大差距,需回归交叉递呈的免疫学过程,寻找缺失的一环。如何将进入细胞质的抗原引导到内质网上,从而完成“最后一公里”递送,可能是关键。然而,整个领域却长期缺乏一种可以完成这项任务的高亲和力内质网靶向分子。
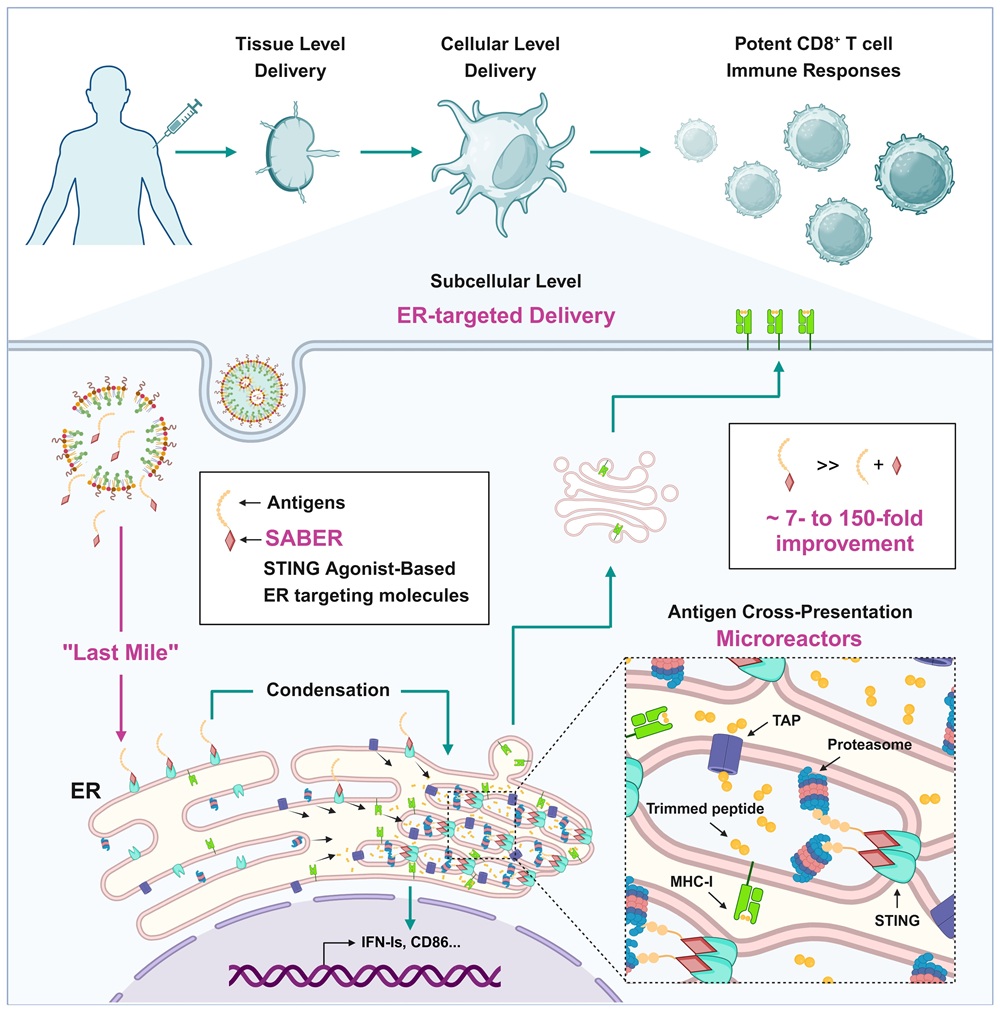
中山大学附属第一医院王骥团队联合复旦大学陆路团队、辽宁大学曾颖玥团队在2025年5月1日出版的《Nature》期刊上发表题为“STING agonist-based ER-targeting molecules boost antigen cross-presentation”的研究论文,研制新型高亲和力内质网靶向小分子,揭示抗原到达内质网这 “最后一公里”对交叉递呈的关键作用,据此首创具有抗原内质网靶向和免疫激活的双功能的新概念疫苗佐剂,大幅提升CD8+ T细胞免疫反应的诱导。《Nature》同期刊发新闻评论文章“Crucial meeting: molecule helps vaccine to interact with killer T cells”。
作者基于其在疫苗佐剂和STING领域十余年的积累,提出位于内质网上的STING蛋白可能是实现内质网靶向的关键突破口,但在靶向分子设计、抗原偶联策略、疫苗剂型工艺等环节面临多重挑战。作者以系统性筛选与理性设计相结合的方式,筛选设计数十种STING激动剂及其抗原接头,最终获得既可以将抗原靶向到内质网,又保持着高效的STING激活功能的SABER分子。作者随后筛选设计与之配伍的脂质纳米粒(LNP)递送系统与微流控包装技术,最终将SABER-抗原复合物制备为高效稳定的疫苗,可以在4度稳定存储140天以上。
作者通过免疫荧光、内质网分离、临近蛋白标记等技术从多维度证实,SABER可有效地将抗原靶向至内质网,并通过STING的寡聚化折叠压缩内质网膜,浓缩抗原与交叉递呈关键元件(如TAP、蛋白酶体),形成高效的交叉递呈“微反应器”,提升抗原处理和转运效率。最终, SABER可以大幅提升DC表面的MHC-I-多肽复合物的数量,以及抗原特异性CD8+ T细胞的扩增。
为深入研究内在机制,作者设计了含二硫键,可在胞内与抗原断开连接的SABER对照分子。可被切断的SABER分子激活STING的能力不受影响,但提升交叉递呈的能力显著降低,证明“抗原的内质网靶向递送”是SABER的核心机制。作者进一步利用体外多亚型DC培养、体内DC亚型分析、Batf3-/-小鼠等手段,发现SABER对cDC1和cDC2同时有效,可在体内驱动多种抗原递呈细胞的交叉递呈。
随后的疫苗接种实验发现, SABER提升 CD8+ T细胞免疫反应诱导的能力不但远高于强效的STING激动剂diABZI,还比对照佐剂Poly I:C、ODN1018和ISCOMs高10倍以上(三针免疫后)。这些佐剂都被报道可有效促进CD8+ T细胞免疫反应诱导。其中,TLR3激动剂Poly I:C被广泛应用于肿瘤新抗原疫苗临床研究,TLR9激动剂ODN1018是商业化乙肝疫苗的佐剂,而ISCOMs家族被用于疟疾疫苗和新冠亚单位疫苗。在小鼠模型中,这些对照佐剂可以将血液中抗原特异性CD8+ T细胞的占比提升到0.5%-3%的水平,而SABER则可以达到30%。
得益于突出的CD8+ T细胞免疫反应诱导能力,基于SABER技术的肿瘤新抗原疫苗和病毒疫苗在多种肿瘤和传染病动物模型中均展现了优异的预防和治疗效果。例如,在对免疫检查点抑制剂治疗抵抗的小鼠黑色素瘤B16F10模型中,仅需以SABER技术制备针对单一新抗原表位的疫苗,就可以有效联合PD-1单抗抑制肿瘤生长,效果显著优于临床研究中广泛使用的Poly I:C。另一方面,基于SABER技术的新冠病毒多肽疫苗,可大幅增强针对保守表位的CD8+ T细胞应答,将变异毒株攻毒后的病毒载量降低100倍。此外,SABER不但能够提升细胞免疫,还拥有与现有主要佐剂相当甚至更高的增强体液免疫反应的能力,与亚单位疫苗联合使用时,可以有效增强交叉保护中和抗体的诱导。
先进的佐剂与递送系统是全球新一代疫苗的显著特征,也是研制下一代具有广谱防护性能的传染病预防性疫苗,以及可彻底清除慢性病毒感染、肿瘤的治疗性疫苗的必备条件。王骥团队长期从事疫苗研究,建立免疫工程研究体系,探索佐剂与递送系统背后的共性免疫学问题,开发研究这些问题的工具,找到解决这些问题的方法。团队于2020年在《Science》期刊上报道调控DC交叉递呈与CD8+ T细胞免疫反应诱导的免疫微环境关键因素,现在进一步将对交叉递呈的调控推进到亚细胞层面。这一系列研究不仅为突破CD8+ T细胞免疫诱导这一长期性的科学难题提供了创新解决方案,更为下一代预防性和治疗性疫苗研发提供了关键的共性底座技术。
中山大学附属第一医院王骥研究员为最后通讯作者,复旦大学基础医学院陆路研究员、辽宁大学生命科学院曾颖玥副教授为共同通讯作者。中山大学附属第一医院王夏峰副研究员、博士生黄章屏、尚丽茹助理研究员、博士后蒋娟,复旦大学博士后邢立晓为本文的共同第一作者。该研究获得国家重点研发计划、国家自然科学基金、辽宁省教育厅科学研究项目等项目的支持。
原文链接:https://www.nature.com/articles/s41586-025-08758-w
抗原交叉递呈主要发生在树突状细胞(DC)中,需要经历抗原被摄取进入细胞质,到达内质网,随后被裁剪装载到MHC-I这一过程。既往研究主要聚焦于设计佐剂与递送系统将抗原投递到DC的细胞质中,激活其先天免疫通路,促进共刺激分子和细胞因子表达。然而,即使已有强效佐剂,CD8+ T细胞免疫反应的诱导仍不及预期。近期文献综述总结发现,临床研究中的肿瘤多肽疫苗所诱导的抗原特异性CD8+ T细胞免疫往往只占血液中总CD8+ T细胞的0.1%,远低于那些可诱导终身防护的活病毒疫苗(如黄热、天花)所能达到的10-20%的水平(Nat Rev Immunol. 2024 Mar;24(3):213-227)。
得益于无数研究团队数十年的努力,现有疫苗技术在抗原摄取和先天免疫通路激活方面的表现已非常优异,要进一步跨越与活病毒疫苗间的巨大差距,需回归交叉递呈的免疫学过程,寻找缺失的一环。如何将进入细胞质的抗原引导到内质网上,从而完成“最后一公里”递送,可能是关键。然而,整个领域却长期缺乏一种可以完成这项任务的高亲和力内质网靶向分子。

中山大学附属第一医院王骥团队联合复旦大学陆路团队、辽宁大学曾颖玥团队在2025年5月1日出版的《Nature》期刊上发表题为“STING agonist-based ER-targeting molecules boost antigen cross-presentation”的研究论文,研制新型高亲和力内质网靶向小分子,揭示抗原到达内质网这 “最后一公里”对交叉递呈的关键作用,据此首创具有抗原内质网靶向和免疫激活的双功能的新概念疫苗佐剂,大幅提升CD8+ T细胞免疫反应的诱导。《Nature》同期刊发新闻评论文章“Crucial meeting: molecule helps vaccine to interact with killer T cells”。
作者基于其在疫苗佐剂和STING领域十余年的积累,提出位于内质网上的STING蛋白可能是实现内质网靶向的关键突破口,但在靶向分子设计、抗原偶联策略、疫苗剂型工艺等环节面临多重挑战。作者以系统性筛选与理性设计相结合的方式,筛选设计数十种STING激动剂及其抗原接头,最终获得既可以将抗原靶向到内质网,又保持着高效的STING激活功能的SABER分子。作者随后筛选设计与之配伍的脂质纳米粒(LNP)递送系统与微流控包装技术,最终将SABER-抗原复合物制备为高效稳定的疫苗,可以在4度稳定存储140天以上。
作者通过免疫荧光、内质网分离、临近蛋白标记等技术从多维度证实,SABER可有效地将抗原靶向至内质网,并通过STING的寡聚化折叠压缩内质网膜,浓缩抗原与交叉递呈关键元件(如TAP、蛋白酶体),形成高效的交叉递呈“微反应器”,提升抗原处理和转运效率。最终, SABER可以大幅提升DC表面的MHC-I-多肽复合物的数量,以及抗原特异性CD8+ T细胞的扩增。
为深入研究内在机制,作者设计了含二硫键,可在胞内与抗原断开连接的SABER对照分子。可被切断的SABER分子激活STING的能力不受影响,但提升交叉递呈的能力显著降低,证明“抗原的内质网靶向递送”是SABER的核心机制。作者进一步利用体外多亚型DC培养、体内DC亚型分析、Batf3-/-小鼠等手段,发现SABER对cDC1和cDC2同时有效,可在体内驱动多种抗原递呈细胞的交叉递呈。
随后的疫苗接种实验发现, SABER提升 CD8+ T细胞免疫反应诱导的能力不但远高于强效的STING激动剂diABZI,还比对照佐剂Poly I:C、ODN1018和ISCOMs高10倍以上(三针免疫后)。这些佐剂都被报道可有效促进CD8+ T细胞免疫反应诱导。其中,TLR3激动剂Poly I:C被广泛应用于肿瘤新抗原疫苗临床研究,TLR9激动剂ODN1018是商业化乙肝疫苗的佐剂,而ISCOMs家族被用于疟疾疫苗和新冠亚单位疫苗。在小鼠模型中,这些对照佐剂可以将血液中抗原特异性CD8+ T细胞的占比提升到0.5%-3%的水平,而SABER则可以达到30%。
得益于突出的CD8+ T细胞免疫反应诱导能力,基于SABER技术的肿瘤新抗原疫苗和病毒疫苗在多种肿瘤和传染病动物模型中均展现了优异的预防和治疗效果。例如,在对免疫检查点抑制剂治疗抵抗的小鼠黑色素瘤B16F10模型中,仅需以SABER技术制备针对单一新抗原表位的疫苗,就可以有效联合PD-1单抗抑制肿瘤生长,效果显著优于临床研究中广泛使用的Poly I:C。另一方面,基于SABER技术的新冠病毒多肽疫苗,可大幅增强针对保守表位的CD8+ T细胞应答,将变异毒株攻毒后的病毒载量降低100倍。此外,SABER不但能够提升细胞免疫,还拥有与现有主要佐剂相当甚至更高的增强体液免疫反应的能力,与亚单位疫苗联合使用时,可以有效增强交叉保护中和抗体的诱导。
先进的佐剂与递送系统是全球新一代疫苗的显著特征,也是研制下一代具有广谱防护性能的传染病预防性疫苗,以及可彻底清除慢性病毒感染、肿瘤的治疗性疫苗的必备条件。王骥团队长期从事疫苗研究,建立免疫工程研究体系,探索佐剂与递送系统背后的共性免疫学问题,开发研究这些问题的工具,找到解决这些问题的方法。团队于2020年在《Science》期刊上报道调控DC交叉递呈与CD8+ T细胞免疫反应诱导的免疫微环境关键因素,现在进一步将对交叉递呈的调控推进到亚细胞层面。这一系列研究不仅为突破CD8+ T细胞免疫诱导这一长期性的科学难题提供了创新解决方案,更为下一代预防性和治疗性疫苗研发提供了关键的共性底座技术。
中山大学附属第一医院王骥研究员为最后通讯作者,复旦大学基础医学院陆路研究员、辽宁大学生命科学院曾颖玥副教授为共同通讯作者。中山大学附属第一医院王夏峰副研究员、博士生黄章屏、尚丽茹助理研究员、博士后蒋娟,复旦大学博士后邢立晓为本文的共同第一作者。该研究获得国家重点研发计划、国家自然科学基金、辽宁省教育厅科学研究项目等项目的支持。
原文链接:https://www.nature.com/articles/s41586-025-08758-w
