学术动态
王皞鹏团队《Cell》揭示免疫检查点LAG3的激活机制,推动癌症精准治疗
作者:王皞鹏 来源自:中国免疫学会 点击数:9875 发布时间:2025-05-20
免疫检查点是T细胞表面的一类抑制性受体。肿瘤通过激活这些免疫检查点,抑制T细胞的抗肿瘤功能,从而实现免疫逃逸。免疫检查点抑制剂则通过解除这种抑制作用,重新激活T细胞介导的抗肿瘤免疫应答(获2018年诺贝尔生理医学奖)。其中,PD-1阻断抗体在多种肿瘤治疗中取得革命性突破,被誉为“药王”。在探索新一代免疫检查点药物的过程中,LAG3成为了极具潜力的靶点,并于2022年成为继PD-1和CTLA-4之后第三个获得FDA批准的免疫检查点药物,标志着免疫检查点治疗进入了新阶段。
然而,与PD-1治疗仅20-30%患者获益类似,LAG3治疗也只有部分患者响应获益。因此,如何精准识别潜在获益人群并扩大治疗获益范围,已成为当前研究的重点问题。要解决这一临床难题,首先需要深入理解LAG3免疫检查点的作用机制。
自1990年发现LAG3蛋白以来,其配体结合后如何触发LAG3受体激活的分子机制一直未能阐明。2025年3月17日,上海科技大学王皞鹏课题组、中国科学院分子细胞科学卓越创新中心许琛琦课题组、美国匹兹堡大学医学院Dario Vignali课题组、北京肿瘤医院孔燕课题组与百济神州沈志荣团队合作,在Cell杂志在线发表题为“Ligand-Induced Ubiquitination Unleashes LAG3 Immune Checkpoint Function by Hindering Membrane Sequestration of Signaling Motifs”的研究论文。该研究首次揭示LAG3受体激活的分子开关机制,并开发了基于功能性生物标志物的疗效预测体系,为靶向免疫检查点的精准治疗提供了新策略。
为探究LAG3的配体响应机制,研究者首先通过蛋白质谱技术对LAG3的翻译后修饰(PTM)进行系统分析,发现LAG3受体结合配体后,其K498位点发生快速多泛素化修饰,且这一修饰在人和小鼠中高度保守。值得注意的是,该泛素化修饰不会介导LAG3的降解,反而对LAG3的功能具有关键作用。另外,FGL1作为新发现的LAG3潜在配体,其是否为LAG3功能性配体(其结合是否可以激活LAG3功能)备受争议。该研究发现,膜结合型FGL1可以作为功能性配体触发LAG3的泛素化修饰并激活其抑制功能;相反,游离状态FGL1蛋白无法激活LAG3的泛素化。这一发现解答了领域长期争议的问题。
研究者进一步采用多种蛋白邻近标记技术,成功鉴定出Cbl蛋白家族(c-Cbl和Cbl-b)为介导LAG3泛素化的关键E3泛素连接酶。利用基因敲除技术,团队证明c-Cbl与Cbl-b具有功能冗余性,共同调控LAG3的泛素化修饰及其抑制功能
为阐明泛素化修饰调控LAG3功能的机制,研究者对其近膜端序列进行分析,发现一个进化保守的碱性残基富集序列(basic residue-rich sequence, BRS)基序。该BRS正电基序位于介导LAG3抑制功能的关键信号元件——FSALE基序上游。后续实验证实,LAG3与其他免疫受体(如CD3ε、IgG、CD28、PD-L1和IL-7R)类似,其近膜的BRS基序会与细胞膜中的酸性磷脂相互作用,从而将关键信号元件FSALE埋藏在细胞内膜中,隔离信号转导。当配体激活LAG3后,多泛素化修饰可破坏BRS基序与膜磷脂的结合,促使LAG3胞内信号域从细胞膜中释放,进而传递抑制性信号,最终抑制T细胞功能及抗肿瘤免疫应答。这种泛素化介导的"埋藏-释放"动态调控机制代表了一种全新的受体活化模式。研究团队进一步在MC38,B16等肿瘤模型中,证明了LAG3泛素化在抑制抗肿瘤免疫应答中的关键作用。
基于上述LAG3激活机制的发现(LAG3泛素化可反映LAG3激活状态.),团队创新研发出用于疗效预测的功能性生物标志物(Functionality Biomarker)。研究表明,该标志物在治疗获益组中的检测值较非获益组显著提升51.7倍(p=0.0379),远超传统表达生物标志物(Expression Biomarker)6.5倍差异(无统计学显著性)。
综上所述,该研究首次阐明了LAG3免疫检查点功能激活的新机制:配体诱导的泛素化通过阻止LAG3信号基序的膜隔离来释放LAG3免疫检查点功能。更重要的是开发了可预测LAG3治疗效果的新型生物标志物,为肿瘤免疫的精准治疗提供了新策略。
哈佛大学医学院教授、Dana-Farber癌症研究所系主任Kai W. Wucherpfennig 在Cell同期发表权威专评,他指出该研究为免疫检查点受体生物学理解增添了新的维度,也为开发新一代免疫检查点疗法提供了重要理论基础。
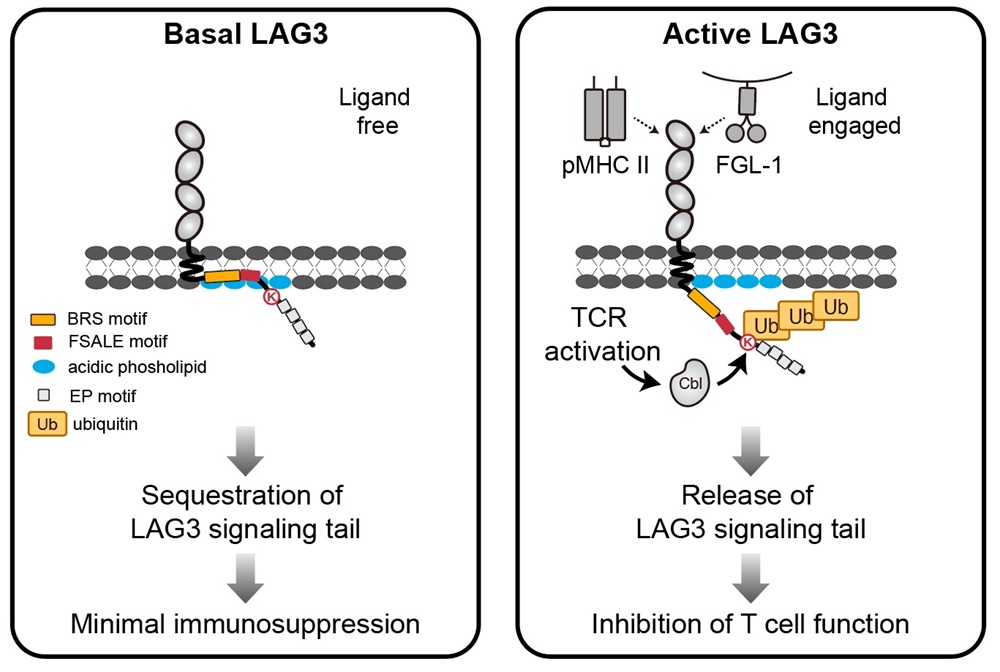
免疫检查点LAG3激活的分子机制示意图
(左图)在静息状态下,LAG3的胞内信号域被细胞膜酸性磷脂所掩藏,处于信号抑制状态。(右图)当LAG3与配体(如pMHCII或FGL-1)结合后,Cbl介导的多聚泛素化修饰触发LAG3构象变化,释放其胞内信号域,激活下游信号通路,从而抑制T细胞功能。
上海科技大学生命学院博士后姜勇、博士研究生戴安冉、黄雨薇、中国科学院分子细胞科学卓越创新中心李华博士与美国匹兹堡大学医学院崔健博士为论文的共同第一作者。上海科技大学副教授王皞鹏、中国科学院分子细胞科学卓越创新中心许琛琦研究员、美国匹兹堡大学医学院Dario A.A. Vignali教授、北京大学肿瘤医院孔燕教授以及百济神州沈志荣博士为论文的共同通讯作者。上海科技大学为该论文的第一完成单位。该项目得到了基金委原创探索项目及上海市科学技术委员会项目的资助。
原文链接:https://www.cell.com/cell/fulltext/S0092-8674(25)00199-0
然而,与PD-1治疗仅20-30%患者获益类似,LAG3治疗也只有部分患者响应获益。因此,如何精准识别潜在获益人群并扩大治疗获益范围,已成为当前研究的重点问题。要解决这一临床难题,首先需要深入理解LAG3免疫检查点的作用机制。
自1990年发现LAG3蛋白以来,其配体结合后如何触发LAG3受体激活的分子机制一直未能阐明。2025年3月17日,上海科技大学王皞鹏课题组、中国科学院分子细胞科学卓越创新中心许琛琦课题组、美国匹兹堡大学医学院Dario Vignali课题组、北京肿瘤医院孔燕课题组与百济神州沈志荣团队合作,在Cell杂志在线发表题为“Ligand-Induced Ubiquitination Unleashes LAG3 Immune Checkpoint Function by Hindering Membrane Sequestration of Signaling Motifs”的研究论文。该研究首次揭示LAG3受体激活的分子开关机制,并开发了基于功能性生物标志物的疗效预测体系,为靶向免疫检查点的精准治疗提供了新策略。
为探究LAG3的配体响应机制,研究者首先通过蛋白质谱技术对LAG3的翻译后修饰(PTM)进行系统分析,发现LAG3受体结合配体后,其K498位点发生快速多泛素化修饰,且这一修饰在人和小鼠中高度保守。值得注意的是,该泛素化修饰不会介导LAG3的降解,反而对LAG3的功能具有关键作用。另外,FGL1作为新发现的LAG3潜在配体,其是否为LAG3功能性配体(其结合是否可以激活LAG3功能)备受争议。该研究发现,膜结合型FGL1可以作为功能性配体触发LAG3的泛素化修饰并激活其抑制功能;相反,游离状态FGL1蛋白无法激活LAG3的泛素化。这一发现解答了领域长期争议的问题。
研究者进一步采用多种蛋白邻近标记技术,成功鉴定出Cbl蛋白家族(c-Cbl和Cbl-b)为介导LAG3泛素化的关键E3泛素连接酶。利用基因敲除技术,团队证明c-Cbl与Cbl-b具有功能冗余性,共同调控LAG3的泛素化修饰及其抑制功能
为阐明泛素化修饰调控LAG3功能的机制,研究者对其近膜端序列进行分析,发现一个进化保守的碱性残基富集序列(basic residue-rich sequence, BRS)基序。该BRS正电基序位于介导LAG3抑制功能的关键信号元件——FSALE基序上游。后续实验证实,LAG3与其他免疫受体(如CD3ε、IgG、CD28、PD-L1和IL-7R)类似,其近膜的BRS基序会与细胞膜中的酸性磷脂相互作用,从而将关键信号元件FSALE埋藏在细胞内膜中,隔离信号转导。当配体激活LAG3后,多泛素化修饰可破坏BRS基序与膜磷脂的结合,促使LAG3胞内信号域从细胞膜中释放,进而传递抑制性信号,最终抑制T细胞功能及抗肿瘤免疫应答。这种泛素化介导的"埋藏-释放"动态调控机制代表了一种全新的受体活化模式。研究团队进一步在MC38,B16等肿瘤模型中,证明了LAG3泛素化在抑制抗肿瘤免疫应答中的关键作用。
基于上述LAG3激活机制的发现(LAG3泛素化可反映LAG3激活状态.),团队创新研发出用于疗效预测的功能性生物标志物(Functionality Biomarker)。研究表明,该标志物在治疗获益组中的检测值较非获益组显著提升51.7倍(p=0.0379),远超传统表达生物标志物(Expression Biomarker)6.5倍差异(无统计学显著性)。
综上所述,该研究首次阐明了LAG3免疫检查点功能激活的新机制:配体诱导的泛素化通过阻止LAG3信号基序的膜隔离来释放LAG3免疫检查点功能。更重要的是开发了可预测LAG3治疗效果的新型生物标志物,为肿瘤免疫的精准治疗提供了新策略。
哈佛大学医学院教授、Dana-Farber癌症研究所系主任Kai W. Wucherpfennig 在Cell同期发表权威专评,他指出该研究为免疫检查点受体生物学理解增添了新的维度,也为开发新一代免疫检查点疗法提供了重要理论基础。

免疫检查点LAG3激活的分子机制示意图
(左图)在静息状态下,LAG3的胞内信号域被细胞膜酸性磷脂所掩藏,处于信号抑制状态。(右图)当LAG3与配体(如pMHCII或FGL-1)结合后,Cbl介导的多聚泛素化修饰触发LAG3构象变化,释放其胞内信号域,激活下游信号通路,从而抑制T细胞功能。
上海科技大学生命学院博士后姜勇、博士研究生戴安冉、黄雨薇、中国科学院分子细胞科学卓越创新中心李华博士与美国匹兹堡大学医学院崔健博士为论文的共同第一作者。上海科技大学副教授王皞鹏、中国科学院分子细胞科学卓越创新中心许琛琦研究员、美国匹兹堡大学医学院Dario A.A. Vignali教授、北京大学肿瘤医院孔燕教授以及百济神州沈志荣博士为论文的共同通讯作者。上海科技大学为该论文的第一完成单位。该项目得到了基金委原创探索项目及上海市科学技术委员会项目的资助。
原文链接:https://www.cell.com/cell/fulltext/S0092-8674(25)00199-0
