学术动态
北京大学陈鹏与合作者开发“多细胞招募”的免疫治疗新策略
作者:陈鹏 来源自:中国免疫学会 点击数:8172 发布时间:2025-01-15
免疫疗法在多个血液瘤中带来了革命性突破,然而在大部分实体瘤治疗领域,免疫疗法响应率低、治疗效果差。其主要原因在于,实体瘤存在复杂且高度异质的肿瘤免疫微环境,多种类型免疫细胞协同影响免疫治疗效果。传统免疫疗法如免疫检查点抑制剂、过继性细胞疗法、双/多特异性抗体等,大多只针对单一类型的免疫细胞发挥作用(如T或NK细胞)。开发出能同时调动多种免疫细胞的治疗策略,将有望最大程度激活免疫,从而大幅度提高实体瘤治疗效果,但目前这种方法仍然未被满足。
2024年12月26日,北京大学化学院陈鹏教授团队联合国内多位交叉学科研究者(北京大学席建忠教授,中国医学科学院肿瘤医院康晓征教授,南京大学李颜教授,北京大学第三医院林坚研究员)在《Cell》期刊正式发表了题为“Multimodal targeting chimeras enable integrated immunotherapy leveraging tumor-immune microenvironment”的研究论文(图)。该论文报道了一种生物正交嵌合体平台,利用其构建的多特异性生物正交偶联臂(T-Linker),完成了三种不同药物模块的特异、高效整合,形成了一系列生物正交嵌合体(Multi-TAC),实现实体瘤微环境中多种免疫细胞的同时招募,显著促进了免疫治疗效果。
首先,作者通过筛选化学反应、优化合成路径,制备了多特异性生物正交偶联臂(T-Linker)。这一偶联臂含有三种不同活性官能团,因此能同时偶联三种带有对应反应官能团的模块。为了展示T-Linker的通用性,他们完成了两种纳米抗体和小分子化合物、核酸、多肽、蛋白等不同模块的偶联。通过进一步整合树枝状连接子和可切割型连接子,他们还展示了T-Linker用于偶联不同比例的模块分子,以及原位释放模块分子的能力。这些实验表明,他们开发的T-Linker偶联平台具有模块化、位点特异、高效等特点,可以精准整合包括抗体在内的任意三种模块分子,产生各种用途的生物正交嵌合体Multi-TACs。
随后,作者探究了其构建的Multi-TAC分子能否用于招募多种免疫细胞,提高免疫治疗效果。肿瘤中T细胞和树突状细胞(DC)已被证明能协同促进抗肿瘤免疫,因此他们开发了EGFR-CD3-PDL1 Multi-TAC用于同时招募T细胞和DC靶向肿瘤。他们研究表明EGFR-CD3-PDL1 Multi-TAC通过结合肿瘤细胞EGFR、T细胞CD3和DC细胞PDL1受体分子,促进“肿瘤细胞-T细胞-DC细胞”三者的物理相互作用,从而同时激活T细胞-DC细胞抗肿瘤免疫。
进一步,作者在三种不同人源化小鼠模型中测试了EGFR-CD3-PDL1 Multi-TAC的活体治疗效果。他们发现EGFR-CD3-PDL1 Multi-TAC能完全控制肿瘤生长,在激活肿瘤T细胞和DC的同时,也重塑了肿瘤免疫微环境。尤其在转基因人源化小鼠模型中,EGFR-CD3-PDL1 Multi-TAC几乎彻底消灭肿瘤,其不但激活了肿瘤内T细胞和DC,还最终诱导了小鼠体内肿瘤特异性免疫反应,这也显示出EGFR-CD3-PDL1 Multi-TAC的治疗能够引发抗肿瘤免疫记忆。
更进一步,作者在临床肿瘤病人组织来源的微肿瘤(PTC)类器官模型中评估了EGFR-CD3-PDL1 Multi-TAC的治疗效果。通过免疫荧光、流式细胞分析和ELISA等多种手段,作者验证了EGFR-CD3-PDL1 Multi-TAC能激活肿瘤病人组织中的T细胞和DC细胞,同时抑制PTC的生长。最终,作者总共测试了6种不同癌症类型,44例肿瘤病人样本。EGFR-CD3-PDL1的整体有效率为75%,而在大部分测试的非小细胞肺癌(NSCLC)样本中,EGFR-CD3-PDL1有效率高达86%,说明EGFR-CD3-PDL1 Multi-TAC具有临床治疗潜力。
除了上述嵌合体,作者还构建和验证了EGFR-CD3-CD16 Multi-TAC,其通过同时结合肿瘤EGFR、T细胞CD3和NK细胞CD16受体,实现了肿瘤靶向的T-NK细胞同时招募。他们还构建和研究了HER2-CD3-(IMDQ)6 Multi-TAC,通过结合肿瘤HER2和T细胞CD3受体,在招募T细胞的同时,能够响应肿瘤还原性微环境,释放6分子的TLR激动剂IMDQ,进而激活癌细胞周围的髓系免疫细胞。
综上所述,此项研究开发了一种高度模块化的生物正交嵌合体平台,该平台可精准整合多种药物模块,从而构建各种类型的多特异性生物正交嵌合体,用于同时招募T、DC、NK以及髓系免疫细胞等,靶向实体瘤免疫微环境。作为代表,EGFR-CD3-PDL1 Multi-TAC通过介导“肿瘤细胞-T细胞-DC细胞”三者的直接相互作用,同时激活了肿瘤组织中T细胞和DC,逆转肿瘤免疫微环境,最终诱导肿瘤特异性免疫响应。这项工作为肿瘤免疫治疗提供了一种全新的思路,同时也可以作为一种研究工具用来精准干预多细胞之间的相互作用。
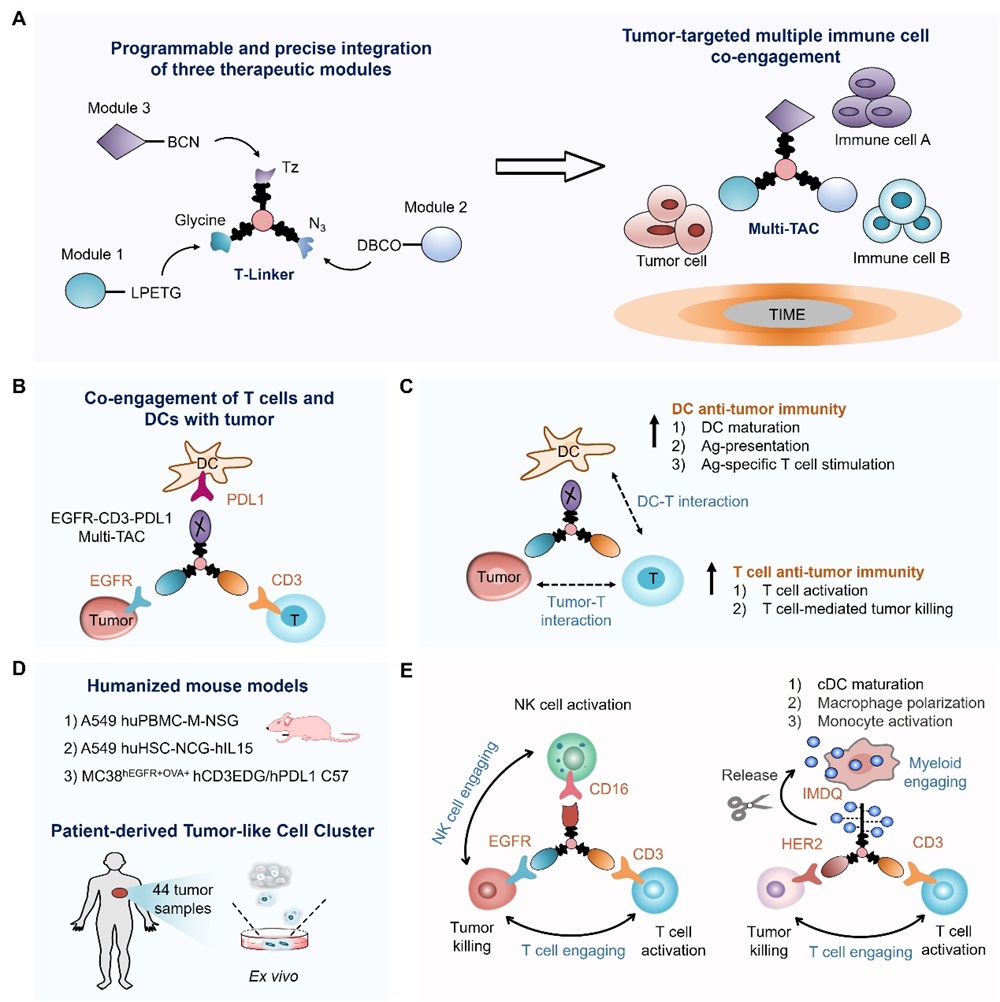
图 生物正交嵌合体(Multi-TAC)平台,用于肿瘤靶向的多种免疫细胞共招募。(A)多特异性生物正交偶联臂(T-Linker)通过多重生物正交化学,模块化、位点特异地整合任意3种药物模块,形成生物正交嵌合体Multi-TAC。该Multi-TAC分子能同时招募两种不同免疫细胞靶向肿瘤。(B)EGFR-CD3-PDL1 Multi-TAC嵌合体用于肿瘤靶向的T-DC细胞共招募。(C)EGFR-CD3-PDL1 Multi-TAC通过促进肿瘤-T-DC细胞物理相互作用,实现同时激活T细胞和DC抗肿瘤免疫。(D)在3种人源化小鼠肿瘤模型和44例临床病人组织微肿瘤(PTC)模型中对EGFR-CD3-PDL1 Multi-TAC进行系统性评估。(E)EGFR-CD3-CD16 Multi-TAC用于T和NK细胞的共招募,HER2-CD3-(IMDQ)6 Multi-TAC用于T细胞和髓系免疫细胞的共招募。
陈鹏课题组专职副研究员林锋博士为论文第一作者。北京大学陈鹏教授、席建忠教授,中国医学科学院肿瘤医院康晓征教授,南京大学李颜教授,北京大学第三医院林坚研究员为论文共同通讯。陈鹏课题组方昊明、曹坤霞、郭玮明、秦珊、张宇萱、鲁承昊、李涵,席建忠课题组尹申意博士、于颍博士以及李颜课题组张子健、朱茹洁在该项工作实验中亦有重要贡献。该工作得到了北京大学化学院、北大-清华生命科学联合中心、国家自然科学基金、新基石科学基金等的大力支持。
原文链接:https://www.cell.com/cell/abstract/S0092-8674(24)01198-X
原文报道:https://pubs.acs.org/doi/10.1021/acschembio.4c00843
2024年12月26日,北京大学化学院陈鹏教授团队联合国内多位交叉学科研究者(北京大学席建忠教授,中国医学科学院肿瘤医院康晓征教授,南京大学李颜教授,北京大学第三医院林坚研究员)在《Cell》期刊正式发表了题为“Multimodal targeting chimeras enable integrated immunotherapy leveraging tumor-immune microenvironment”的研究论文(图)。该论文报道了一种生物正交嵌合体平台,利用其构建的多特异性生物正交偶联臂(T-Linker),完成了三种不同药物模块的特异、高效整合,形成了一系列生物正交嵌合体(Multi-TAC),实现实体瘤微环境中多种免疫细胞的同时招募,显著促进了免疫治疗效果。
首先,作者通过筛选化学反应、优化合成路径,制备了多特异性生物正交偶联臂(T-Linker)。这一偶联臂含有三种不同活性官能团,因此能同时偶联三种带有对应反应官能团的模块。为了展示T-Linker的通用性,他们完成了两种纳米抗体和小分子化合物、核酸、多肽、蛋白等不同模块的偶联。通过进一步整合树枝状连接子和可切割型连接子,他们还展示了T-Linker用于偶联不同比例的模块分子,以及原位释放模块分子的能力。这些实验表明,他们开发的T-Linker偶联平台具有模块化、位点特异、高效等特点,可以精准整合包括抗体在内的任意三种模块分子,产生各种用途的生物正交嵌合体Multi-TACs。
随后,作者探究了其构建的Multi-TAC分子能否用于招募多种免疫细胞,提高免疫治疗效果。肿瘤中T细胞和树突状细胞(DC)已被证明能协同促进抗肿瘤免疫,因此他们开发了EGFR-CD3-PDL1 Multi-TAC用于同时招募T细胞和DC靶向肿瘤。他们研究表明EGFR-CD3-PDL1 Multi-TAC通过结合肿瘤细胞EGFR、T细胞CD3和DC细胞PDL1受体分子,促进“肿瘤细胞-T细胞-DC细胞”三者的物理相互作用,从而同时激活T细胞-DC细胞抗肿瘤免疫。
进一步,作者在三种不同人源化小鼠模型中测试了EGFR-CD3-PDL1 Multi-TAC的活体治疗效果。他们发现EGFR-CD3-PDL1 Multi-TAC能完全控制肿瘤生长,在激活肿瘤T细胞和DC的同时,也重塑了肿瘤免疫微环境。尤其在转基因人源化小鼠模型中,EGFR-CD3-PDL1 Multi-TAC几乎彻底消灭肿瘤,其不但激活了肿瘤内T细胞和DC,还最终诱导了小鼠体内肿瘤特异性免疫反应,这也显示出EGFR-CD3-PDL1 Multi-TAC的治疗能够引发抗肿瘤免疫记忆。
更进一步,作者在临床肿瘤病人组织来源的微肿瘤(PTC)类器官模型中评估了EGFR-CD3-PDL1 Multi-TAC的治疗效果。通过免疫荧光、流式细胞分析和ELISA等多种手段,作者验证了EGFR-CD3-PDL1 Multi-TAC能激活肿瘤病人组织中的T细胞和DC细胞,同时抑制PTC的生长。最终,作者总共测试了6种不同癌症类型,44例肿瘤病人样本。EGFR-CD3-PDL1的整体有效率为75%,而在大部分测试的非小细胞肺癌(NSCLC)样本中,EGFR-CD3-PDL1有效率高达86%,说明EGFR-CD3-PDL1 Multi-TAC具有临床治疗潜力。
除了上述嵌合体,作者还构建和验证了EGFR-CD3-CD16 Multi-TAC,其通过同时结合肿瘤EGFR、T细胞CD3和NK细胞CD16受体,实现了肿瘤靶向的T-NK细胞同时招募。他们还构建和研究了HER2-CD3-(IMDQ)6 Multi-TAC,通过结合肿瘤HER2和T细胞CD3受体,在招募T细胞的同时,能够响应肿瘤还原性微环境,释放6分子的TLR激动剂IMDQ,进而激活癌细胞周围的髓系免疫细胞。
综上所述,此项研究开发了一种高度模块化的生物正交嵌合体平台,该平台可精准整合多种药物模块,从而构建各种类型的多特异性生物正交嵌合体,用于同时招募T、DC、NK以及髓系免疫细胞等,靶向实体瘤免疫微环境。作为代表,EGFR-CD3-PDL1 Multi-TAC通过介导“肿瘤细胞-T细胞-DC细胞”三者的直接相互作用,同时激活了肿瘤组织中T细胞和DC,逆转肿瘤免疫微环境,最终诱导肿瘤特异性免疫响应。这项工作为肿瘤免疫治疗提供了一种全新的思路,同时也可以作为一种研究工具用来精准干预多细胞之间的相互作用。

图 生物正交嵌合体(Multi-TAC)平台,用于肿瘤靶向的多种免疫细胞共招募。(A)多特异性生物正交偶联臂(T-Linker)通过多重生物正交化学,模块化、位点特异地整合任意3种药物模块,形成生物正交嵌合体Multi-TAC。该Multi-TAC分子能同时招募两种不同免疫细胞靶向肿瘤。(B)EGFR-CD3-PDL1 Multi-TAC嵌合体用于肿瘤靶向的T-DC细胞共招募。(C)EGFR-CD3-PDL1 Multi-TAC通过促进肿瘤-T-DC细胞物理相互作用,实现同时激活T细胞和DC抗肿瘤免疫。(D)在3种人源化小鼠肿瘤模型和44例临床病人组织微肿瘤(PTC)模型中对EGFR-CD3-PDL1 Multi-TAC进行系统性评估。(E)EGFR-CD3-CD16 Multi-TAC用于T和NK细胞的共招募,HER2-CD3-(IMDQ)6 Multi-TAC用于T细胞和髓系免疫细胞的共招募。
陈鹏课题组专职副研究员林锋博士为论文第一作者。北京大学陈鹏教授、席建忠教授,中国医学科学院肿瘤医院康晓征教授,南京大学李颜教授,北京大学第三医院林坚研究员为论文共同通讯。陈鹏课题组方昊明、曹坤霞、郭玮明、秦珊、张宇萱、鲁承昊、李涵,席建忠课题组尹申意博士、于颍博士以及李颜课题组张子健、朱茹洁在该项工作实验中亦有重要贡献。该工作得到了北京大学化学院、北大-清华生命科学联合中心、国家自然科学基金、新基石科学基金等的大力支持。
原文链接:https://www.cell.com/cell/abstract/S0092-8674(24)01198-X
原文报道:https://pubs.acs.org/doi/10.1021/acschembio.4c00843
