学术动态
沈蕾团队揭示LKB1信号调控胰岛素抵抗的分子机制
作者:沈蕾 来源自:中国免疫学会 点击数:11440 发布时间:2024-07-08
肥胖是2型糖尿病(Type 2 diabetes mellitus,T2D)的重要危险因素,其中肥胖导致的脂肪慢性炎症是肥胖相关胰岛素抵抗的重要原因。ILC2在维持脂肪组织抗炎微环境中起到核心调控作用,不仅可以通过分泌2型细胞因子(IL-4,IL-5和IL-13)激活M2型巨噬细胞和招募嗜酸性粒细胞来抑制脂肪组织炎症反应,还能够促进白色脂肪米色化减轻肥胖。由于ILC2具有上述的双重调控作用,因此靶向ILC2成为防治肥胖及相关代谢性疾病的一个重要策略。已有研究报道肥胖状态下小鼠和人的脂肪组织ILC2均发生功能异常,然而肥胖导致ILC2功能失调的分子调控机制尚不清楚。
2024年5月20日,上海交通大学医学院上海市免疫学研究所沈蕾团队在Immunity杂志在线发表题为“Metabolic regulator LKB1 controls adipose tissue ILC2 PD-1 expression and mitochondrial homeostasis to prevent insulin resistance”的研究论文。该研究发现肝激酶B1 (Liver Kinase B1,LKB1) 信号通过抑制脂肪组织2型固有淋巴样细胞(Group 2 Innate Lymphoid Cell,ILC2)PD-1表达和线粒体自噬来维持其效应功能及机体对胰岛素的敏感性,阐明了肥胖状态下脂肪组织ILC2细胞功能受损的分子机制,为靶向ILC2治疗胰岛素抵抗相关的代谢性疾病提供了新的靶点。
研究人员通过对肥胖小鼠脂肪组织ILC2进行转录组测序分析,发现ILC2线粒体代谢变化显著,并且细胞代谢重要调控因子LKB1信号严重受损。通过构建ILC2特异性缺失LKB1的小鼠(Il5RFP-creStk11f/f),发现LKB1缺失导致脂肪ILC2细胞数量减少,IL-5和IL-13分泌降低,脂肪组织炎症加重,从而促进肥胖诱导的胰岛素抵抗。进一步分子机制研究揭示LKB1通过ROS-NFAT2信号抑制ILC2表达PD-1,进而通过增加Bcl-xL表达水平抑制PINK1-Parkin信号介导的线粒体自噬,从而维持ILC2细胞代谢稳态和免疫效应功能。
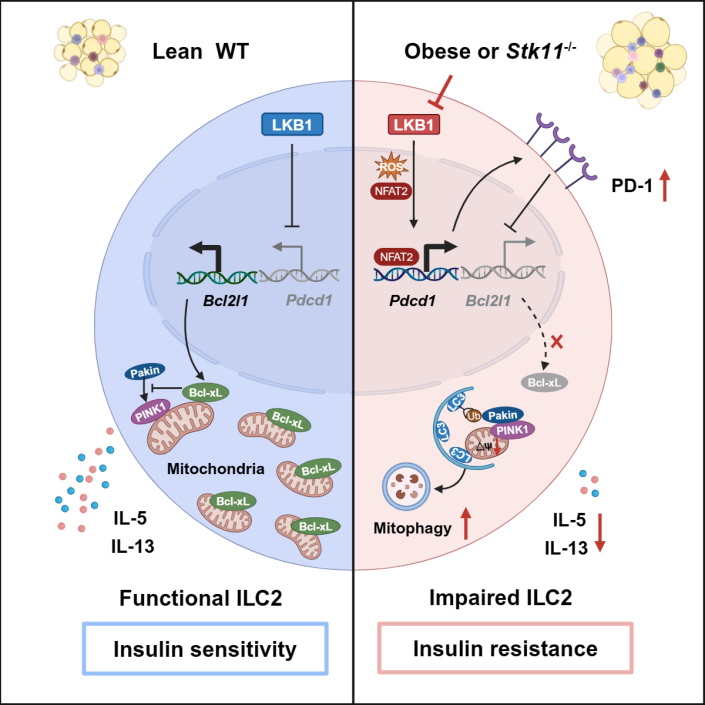
图:LKB1-PD-1信号轴调控脂肪组织ILC2线粒体代谢和效应功能及胰岛素抵抗
该研究还发现PD-1抗体阻断治疗显著改善肥胖小鼠的胰岛素抵抗,ILC2过继转输实验和ILC2特异性清除小鼠(Nmur1icreDTRf/+)证明了PD-1抗体治疗效果依赖于ILC2。有趣的是,研究团队在T2D病人的内脏脂肪ILC2中也观察到LKB1信号受损和PD-1表达水平升高,并且PD-1抗体阻断能够增强人脂肪ILC2的免疫效应功能。综上,本研究阐明了肥胖状态下脂肪组织ILC2细胞功能受损的分子调控机制,并且提示靶向LKB1-PD-1信号轴治疗T2D具有较大的临床应用前景。
上海交通大学医学院上海市免疫学研究所沈蕾研究员为文章的通讯作者,助理研究员孙计萍和博士生张有琴为文章的共同第一作者。本研究受到科技部国家重点研发计划、国家自然科学基金、上海市自然科学基金等项目资助和上海市免疫学研究所公共技术平台的支持。
原文链接:https://www.sciencedirect.com/science/article/pii/S1074761324002292
2024年5月20日,上海交通大学医学院上海市免疫学研究所沈蕾团队在Immunity杂志在线发表题为“Metabolic regulator LKB1 controls adipose tissue ILC2 PD-1 expression and mitochondrial homeostasis to prevent insulin resistance”的研究论文。该研究发现肝激酶B1 (Liver Kinase B1,LKB1) 信号通过抑制脂肪组织2型固有淋巴样细胞(Group 2 Innate Lymphoid Cell,ILC2)PD-1表达和线粒体自噬来维持其效应功能及机体对胰岛素的敏感性,阐明了肥胖状态下脂肪组织ILC2细胞功能受损的分子机制,为靶向ILC2治疗胰岛素抵抗相关的代谢性疾病提供了新的靶点。
研究人员通过对肥胖小鼠脂肪组织ILC2进行转录组测序分析,发现ILC2线粒体代谢变化显著,并且细胞代谢重要调控因子LKB1信号严重受损。通过构建ILC2特异性缺失LKB1的小鼠(Il5RFP-creStk11f/f),发现LKB1缺失导致脂肪ILC2细胞数量减少,IL-5和IL-13分泌降低,脂肪组织炎症加重,从而促进肥胖诱导的胰岛素抵抗。进一步分子机制研究揭示LKB1通过ROS-NFAT2信号抑制ILC2表达PD-1,进而通过增加Bcl-xL表达水平抑制PINK1-Parkin信号介导的线粒体自噬,从而维持ILC2细胞代谢稳态和免疫效应功能。

图:LKB1-PD-1信号轴调控脂肪组织ILC2线粒体代谢和效应功能及胰岛素抵抗
该研究还发现PD-1抗体阻断治疗显著改善肥胖小鼠的胰岛素抵抗,ILC2过继转输实验和ILC2特异性清除小鼠(Nmur1icreDTRf/+)证明了PD-1抗体治疗效果依赖于ILC2。有趣的是,研究团队在T2D病人的内脏脂肪ILC2中也观察到LKB1信号受损和PD-1表达水平升高,并且PD-1抗体阻断能够增强人脂肪ILC2的免疫效应功能。综上,本研究阐明了肥胖状态下脂肪组织ILC2细胞功能受损的分子调控机制,并且提示靶向LKB1-PD-1信号轴治疗T2D具有较大的临床应用前景。
上海交通大学医学院上海市免疫学研究所沈蕾研究员为文章的通讯作者,助理研究员孙计萍和博士生张有琴为文章的共同第一作者。本研究受到科技部国家重点研发计划、国家自然科学基金、上海市自然科学基金等项目资助和上海市免疫学研究所公共技术平台的支持。
原文链接:https://www.sciencedirect.com/science/article/pii/S1074761324002292
