学术动态
中山大学周怡/陈崴团队《Immunity》发文揭示ILC3s肠-肾迁移在肾脏纤维化中的关键作用
作者:周怡 来源自:中国免疫学会 点击数:13353 发布时间:2024-06-19
肾脏纤维化是各种慢性肾脏病(CKD)进展至终末期肾脏病(ESKD)的共同通路和最终病理结局,是导致肾功能逐渐丧失的关键决定因素。既往研究表明,免疫细胞浸润引发的持续炎症反应是肾脏纤维化的启动环节,因此,深入探讨肾脏损伤后免疫炎症反应对临床防治肾脏纤维化、延缓CKD进展具有重要意义。固有淋巴细胞(ILCs)是近年来新定义的一群具有适应性免疫特征的固有免疫亚群,3型固有淋巴细胞(ILC3s)属于ILCs三大亚群之一,主要富集于肠道等黏膜屏障组织,并在多种组织的宿主防御、炎症、肿瘤、组织重塑和修复以及代谢稳态中发挥重要作用。近年来,ILC3s在脏器慢性炎症和纤维化中的关键作用日益受到关注,然而,关于ILC3s是否参与肾脏纤维化仍然未知。
2024年6月11日,中山大学附属第一医院周怡研究员、陈崴教授及哈佛医学院布莱根妇女医院Joseph V. Bonventre教授合作在《Immunity》杂志上发表题为“Intestinal CXCR6+ ILC3s migrate to the kidney and exacerbate renal fibrosis via IL-23 receptor signaling enhanced by PD-1 expression”的研究论文。该研究发现,肾脏损伤后,富集于小肠的CXCR6+ ILC3s可迁移至肾脏,并通过表达PD-1放大IL-23R/STAT3/RORγt/IL-17A信号通路,活化成纤维细胞,促进肾脏纤维化的发生发展。
研究者首先检测了ILCs在CKD患者肾脏中的分布特征以及与纤维化的关系,发现ILCs在纤维化肾脏中显著增加,且主要分布于纤维灶中,分布密度与纤维化程度显著正相关。进一步在CKD患者肾活检标本和外周血分析发现,ILC3s是纤维化肾脏中增加的主要ILCs亚群,与患者肾脏纤维化严重程度以及肾功能丢失密切相关。同时,研究者采用了多种小鼠肾脏纤维化模型,发现了和CKD患者同样的现象。
随后,研究者发现,纤维化肾脏中聚集的ILC3s伴随着小肠ILC3s显著减少,利用Kaede转基因小鼠进行体内示踪,发现小肠是肾脏中ILC3s的主要来源。小肠和肾脏中ILC3s均高表达CXCR6,且其相应配体CXCL16在损伤肾小管明显上调;敲除CXCR6或使用CXCL16中和抗体均可显著阻断ILC3s的肠-肾迁移;表明小肠ILC3s主要通过CXCR6/CXCL16趋化轴迁移至肾脏。
接下来,研究者通过阻断迁移、骨髓移植、输注回补、中和实验、过继转移等多种方法探讨了ILC3s在肾脏纤维化中的作用及机制。研究发现,迁移至肾脏的ILC3s在肾脏炎症环境作用下上调表达PD-1,产生大量IL-17A,活化成纤维细胞,促进纤维灶的形成,进而加剧肾脏纤维化。
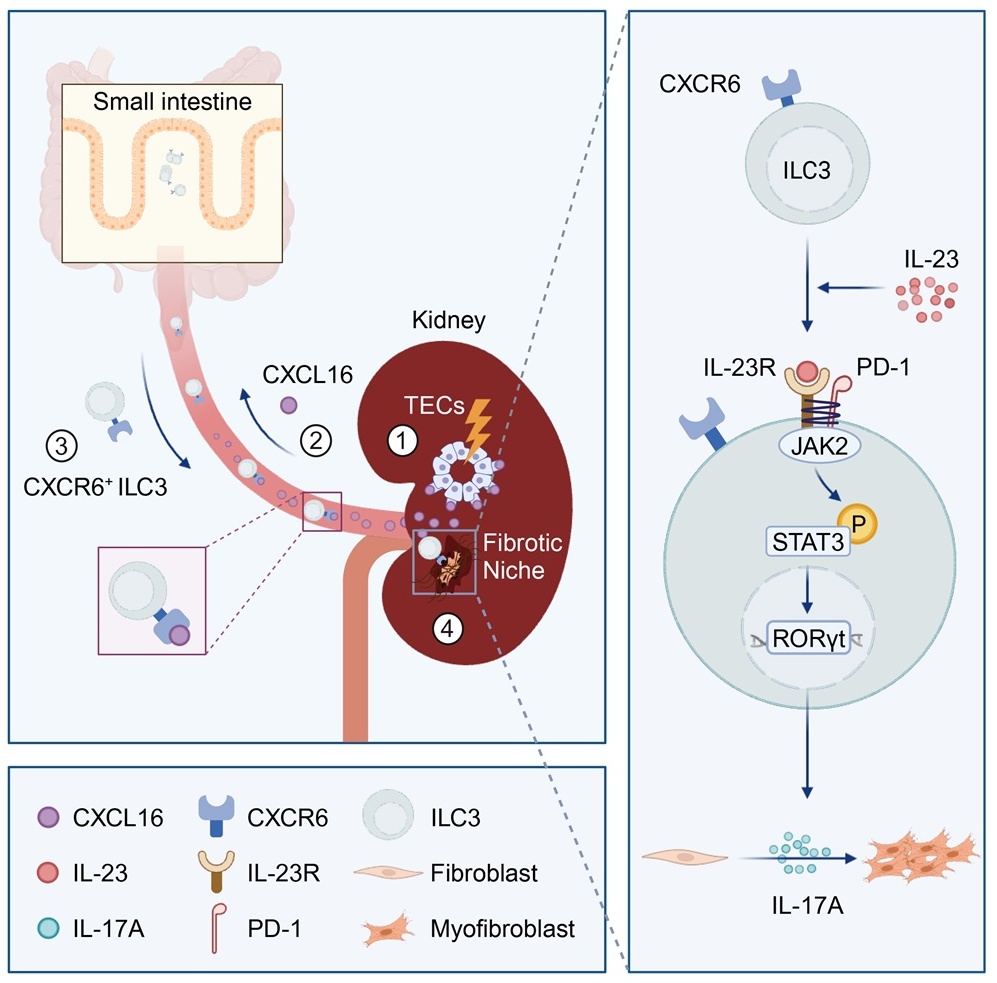
综上,该研究首次报道了ILC3s在肾脏纤维化中关键作用,以及肾脏ILC3s的肠道来源及具体迁移机制,为肾脏损伤修复的免疫调控机制和治疗策略提供新的理论基础和实验依据,并为肾脏纤维化的肠道干预策略提供新的思路。
中山大学附属第一医院肾内科为该论文第一单位。中山大学附属第一医院肾内科周怡研究员、陈崴教授和哈佛医学院布莱根妇女医院肾内科Joseph V. Bonventre教授为该论文共同通讯作者。肾内科博士后梁州、博士生唐子雯、朱昌健为该论文共同第一作者。本研究受到国家自然科学基金、国家卫生健康委员会肾脏病临床研究重点实验室(中山大学)和广东省肾脏病重点实验室经费、广东省自然科学基金,以及广东省特支计划的资助。
原文链接:https://doi.org/10.1016/j.immuni.2024.05.004
2024年6月11日,中山大学附属第一医院周怡研究员、陈崴教授及哈佛医学院布莱根妇女医院Joseph V. Bonventre教授合作在《Immunity》杂志上发表题为“Intestinal CXCR6+ ILC3s migrate to the kidney and exacerbate renal fibrosis via IL-23 receptor signaling enhanced by PD-1 expression”的研究论文。该研究发现,肾脏损伤后,富集于小肠的CXCR6+ ILC3s可迁移至肾脏,并通过表达PD-1放大IL-23R/STAT3/RORγt/IL-17A信号通路,活化成纤维细胞,促进肾脏纤维化的发生发展。
研究者首先检测了ILCs在CKD患者肾脏中的分布特征以及与纤维化的关系,发现ILCs在纤维化肾脏中显著增加,且主要分布于纤维灶中,分布密度与纤维化程度显著正相关。进一步在CKD患者肾活检标本和外周血分析发现,ILC3s是纤维化肾脏中增加的主要ILCs亚群,与患者肾脏纤维化严重程度以及肾功能丢失密切相关。同时,研究者采用了多种小鼠肾脏纤维化模型,发现了和CKD患者同样的现象。
随后,研究者发现,纤维化肾脏中聚集的ILC3s伴随着小肠ILC3s显著减少,利用Kaede转基因小鼠进行体内示踪,发现小肠是肾脏中ILC3s的主要来源。小肠和肾脏中ILC3s均高表达CXCR6,且其相应配体CXCL16在损伤肾小管明显上调;敲除CXCR6或使用CXCL16中和抗体均可显著阻断ILC3s的肠-肾迁移;表明小肠ILC3s主要通过CXCR6/CXCL16趋化轴迁移至肾脏。
接下来,研究者通过阻断迁移、骨髓移植、输注回补、中和实验、过继转移等多种方法探讨了ILC3s在肾脏纤维化中的作用及机制。研究发现,迁移至肾脏的ILC3s在肾脏炎症环境作用下上调表达PD-1,产生大量IL-17A,活化成纤维细胞,促进纤维灶的形成,进而加剧肾脏纤维化。

综上,该研究首次报道了ILC3s在肾脏纤维化中关键作用,以及肾脏ILC3s的肠道来源及具体迁移机制,为肾脏损伤修复的免疫调控机制和治疗策略提供新的理论基础和实验依据,并为肾脏纤维化的肠道干预策略提供新的思路。
中山大学附属第一医院肾内科为该论文第一单位。中山大学附属第一医院肾内科周怡研究员、陈崴教授和哈佛医学院布莱根妇女医院肾内科Joseph V. Bonventre教授为该论文共同通讯作者。肾内科博士后梁州、博士生唐子雯、朱昌健为该论文共同第一作者。本研究受到国家自然科学基金、国家卫生健康委员会肾脏病临床研究重点实验室(中山大学)和广东省肾脏病重点实验室经费、广东省自然科学基金,以及广东省特支计划的资助。
原文链接:https://doi.org/10.1016/j.immuni.2024.05.004
