学术动态
王红艳/魏滨/唐惠儒/叶幼琼团队合作揭示胆固醇代谢调控巨噬细胞抗肿瘤的新机制
作者:王红艳 来源自:中国免疫学会 点击数:11788 发布时间:2024-04-19
巨噬细胞响应病原微生物感染,能分泌促炎细胞因子及干扰素等清除病原,也能响应肿瘤微环境或细胞因子IL-4/IL-13的刺激,表达抑炎细胞因子和精氨酸酶(Arg1)以消耗微环境中的精氨酸,阻断T细胞增殖和杀伤肿瘤的功能。胆固醇代谢物是细胞膜和细胞器膜的重要成分,能调控细胞增殖、迁移和炎症等功能,胆固醇紊乱则与多种疾病相关。实验室前期合作发现7-脱氢胆固醇积累能促进一型干扰素产生,这与胆固醇抑制干扰素的功能截然相反(Xiao et al., Immunity 2020)。胆固醇氧化成25-羟基胆固醇(25-Hydroxycholesterol, 25-HC),25-HC进一步氧化产生7a,25-羟胆固醇,均在自生免疫病SLE病人外周血中升高。7a,25-羟胆固醇通过结合和激活巨噬细胞表面的G蛋白偶联受体EBI2, 抑制多种趋化因子和炎症因子的表达,减轻了SLE发病(Zhang et al., Adv Sci 2023)。但是并不清楚胆固醇代谢如何调控肿瘤相关巨噬细胞(Tumor-Associated Macrophages, TAMs)的免疫抑制功能及分子机制。
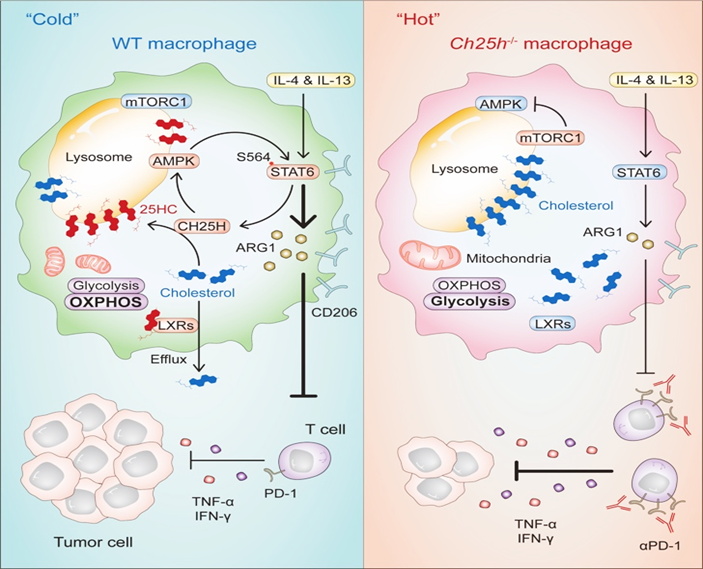
2024年4月18日,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)王红艳研究员、上海大学魏滨教授、复旦大学唐惠儒教授、上海交通大学叶幼琼研究员在IMMUNITY杂志上发表题为“25-Hydroxycholesterol regulates lysosome AMP kinase activation and metabolic reprogramming to educate immunosuppressive macrophages”的研究论文,揭示胆固醇25-羟化酶(cholesterol-25-hydroxylase, CH25H)是肿瘤免疫治疗的代谢新靶点。TAMs被肿瘤微环境诱导升高表达CH25H,累积的25-HC能促进TAMs表达Arg1等,导致肿瘤发展加速。敲除巨噬细胞的CH25H,通过增强微环境中T 细胞数量和活化杀伤功能,将冷肿瘤转变成热肿瘤,并协同anti-PD1进一步提高抗肿瘤疗效。

作者利用3种免疫抑制型巨噬细胞,包括细胞因子IL-4和IL-13刺激的M2型巨噬细胞、肝癌细胞系Hepa1-6条件性培养基孵育的巨噬细胞、实体肿瘤组织中分选的TAMs,筛选胆固醇代谢酶的表达水平,发现胆固醇氧化酶CH25H均被诱导高表达。程根宏等课题组前期已经证实感染促进CH25H高表达,将胆固醇氧化为25-HC,以阻断病毒通过膜融合的方式入侵宿主细胞。本研究发现M2型巨噬细胞、TAMs及肿瘤组织中氧化固醇25-HC的水平升高。scRNA-seq分析已发表的数据,发现多种实体肿瘤组织中MARCO+ TAMs或LYVE1+ TAMs高表达Ch25h,且与肿瘤病人预后负相关。
进一步研究发现肿瘤微环境中的乳酸能诱导Ch25h,以及细胞因子IL-4/IL-13通过转录因子STAT6调控Ch25h转录。累积的25-HC在巨噬细胞溶酶体聚集,并与胆固醇竞争结合溶酶体定位的信号蛋白GPR155,以抑制mTORC1活化。通过增强AMPKa活化,使得转录因子STAT6第564位丝氨酸磷酸化以增强STAT6的转录活性,最终促进巨噬细胞产生更多Arg1和抑炎因子。在巨噬细胞中敲除Ch25h能逆转TAM的免疫抑制功能,阻断多种皮下肿瘤的发展,并伴有肿瘤组织中增强的T细胞浸润和活化及高表达免疫检查点PD-1,因此anti-PD1单抗联用能进一步增强抗肿瘤效果。
综上所述,靶向胆固醇氧化酶CH25H促进了“冷肿瘤”向“热肿瘤”转变,并能联合免疫检查点以提高肿瘤免疫的疗效。由于氧化固醇含量少,不稳定,难以定量和定位。通过合作,我们率先提出氧化固醇和胆固醇定位在溶酶体,相互制衡以调控巨噬细胞命运的概念,并将胆固醇氧化酶CH25H和氧化固醇25-HC,从感染领域拓展到肿瘤免疫治疗领域。
中国科学院分子细胞科学卓越创新中心肖俊副研究员(现任南通大学附属医院研究员),国科大杭州高等研究院王爽博士后和复旦大学生命科学学院陈龙龙是本文的共同第一作者。感谢中国科学院分子细胞科学卓越创新中心惠利健研究员和同济大学附属东方医院胡淼医生在临床样本上提供的帮助。该研究得到中国科学院分子细胞科学卓越创新中心动物平台、细胞平台和分子平台的大力支持。
原文链接:https://doi.org/10.1016/j.immuni.2024.03.021
2024年4月18日,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)王红艳研究员、上海大学魏滨教授、复旦大学唐惠儒教授、上海交通大学叶幼琼研究员在IMMUNITY杂志上发表题为“25-Hydroxycholesterol regulates lysosome AMP kinase activation and metabolic reprogramming to educate immunosuppressive macrophages”的研究论文,揭示胆固醇25-羟化酶(cholesterol-25-hydroxylase, CH25H)是肿瘤免疫治疗的代谢新靶点。TAMs被肿瘤微环境诱导升高表达CH25H,累积的25-HC能促进TAMs表达Arg1等,导致肿瘤发展加速。敲除巨噬细胞的CH25H,通过增强微环境中T 细胞数量和活化杀伤功能,将冷肿瘤转变成热肿瘤,并协同anti-PD1进一步提高抗肿瘤疗效。

作者利用3种免疫抑制型巨噬细胞,包括细胞因子IL-4和IL-13刺激的M2型巨噬细胞、肝癌细胞系Hepa1-6条件性培养基孵育的巨噬细胞、实体肿瘤组织中分选的TAMs,筛选胆固醇代谢酶的表达水平,发现胆固醇氧化酶CH25H均被诱导高表达。程根宏等课题组前期已经证实感染促进CH25H高表达,将胆固醇氧化为25-HC,以阻断病毒通过膜融合的方式入侵宿主细胞。本研究发现M2型巨噬细胞、TAMs及肿瘤组织中氧化固醇25-HC的水平升高。scRNA-seq分析已发表的数据,发现多种实体肿瘤组织中MARCO+ TAMs或LYVE1+ TAMs高表达Ch25h,且与肿瘤病人预后负相关。
进一步研究发现肿瘤微环境中的乳酸能诱导Ch25h,以及细胞因子IL-4/IL-13通过转录因子STAT6调控Ch25h转录。累积的25-HC在巨噬细胞溶酶体聚集,并与胆固醇竞争结合溶酶体定位的信号蛋白GPR155,以抑制mTORC1活化。通过增强AMPKa活化,使得转录因子STAT6第564位丝氨酸磷酸化以增强STAT6的转录活性,最终促进巨噬细胞产生更多Arg1和抑炎因子。在巨噬细胞中敲除Ch25h能逆转TAM的免疫抑制功能,阻断多种皮下肿瘤的发展,并伴有肿瘤组织中增强的T细胞浸润和活化及高表达免疫检查点PD-1,因此anti-PD1单抗联用能进一步增强抗肿瘤效果。
综上所述,靶向胆固醇氧化酶CH25H促进了“冷肿瘤”向“热肿瘤”转变,并能联合免疫检查点以提高肿瘤免疫的疗效。由于氧化固醇含量少,不稳定,难以定量和定位。通过合作,我们率先提出氧化固醇和胆固醇定位在溶酶体,相互制衡以调控巨噬细胞命运的概念,并将胆固醇氧化酶CH25H和氧化固醇25-HC,从感染领域拓展到肿瘤免疫治疗领域。

中国科学院分子细胞科学卓越创新中心肖俊副研究员(现任南通大学附属医院研究员),国科大杭州高等研究院王爽博士后和复旦大学生命科学学院陈龙龙是本文的共同第一作者。感谢中国科学院分子细胞科学卓越创新中心惠利健研究员和同济大学附属东方医院胡淼医生在临床样本上提供的帮助。该研究得到中国科学院分子细胞科学卓越创新中心动物平台、细胞平台和分子平台的大力支持。
原文链接:https://doi.org/10.1016/j.immuni.2024.03.021
