科普天地
动物体内的“另类”抗体
作者:李任峰 来源自:中国免疫学会 点击数:78434 发布时间:2020-08-20
2019年岁末,新冠肺炎(COVID-19)这只“黑天鹅”突然造访人类,给每个人的生活带来深刻影响。在当前仍缺乏疫苗和特效药物的情况下,康复者血浆疗法用于COVID-19重症患者效果较好,已被列入我国《新型冠状病毒肺炎诊疗方案》,并被多个国家参考使用。该疗法主要是利用康复者体内产生的抗体中和患者体内的病毒,阻止病毒感染细胞,从而起到紧急治疗作用。抗体不仅是抗击传染病方面的“明星”,也是肿瘤免疫疗法当中的“硬核”。特别值得一提的是,从最早抗血清的发现到第一株单克隆抗体的诞生都离不开动物的参与,认识和发掘动物抗体资源将为人类健康提供更多帮助。
抗体的发现—诺贝尔生理学或医学奖的“首秀”
让我们先来看看抗体是怎么被发现的。1796年,英国乡村医生琴纳(Edward Jenner)发现接种牛痘可以预防天花,从此开创了免疫学发展的先河。19世纪,以法国化学家巴斯德(Louis Pasteur)和德国医生科霍(Robert Koch)为代表的科学家们证明了传染病的病原菌学说,并发明了多种病原的分离培养技术和疫苗。然而,受到当时科学水平的限制,人们并不清楚为什么打疫苗就能使人抵抗传染病?免疫系统又是如何发挥作用的?
1890年,德国Koch研究所的贝林(Emil Adolf von Behring)和日本的北里柴三郎在《德国医学周刊》发表文章,阐述了如何利用抗血清预防和治疗白喉及破伤风。他们最早将血清中的这种能中和毒素的因子称为抗毒素,即我们今天所说的抗体,从此拉开了抗体研究的大幕。
1901年,贝林因其在抗血清方面的研究贡献获得了第一届诺贝尔生理学或医学奖,这是诺贝尔奖开始颁发的第一年,也成为诺贝尔生理学或医学奖的“首秀”。
抗体的种类
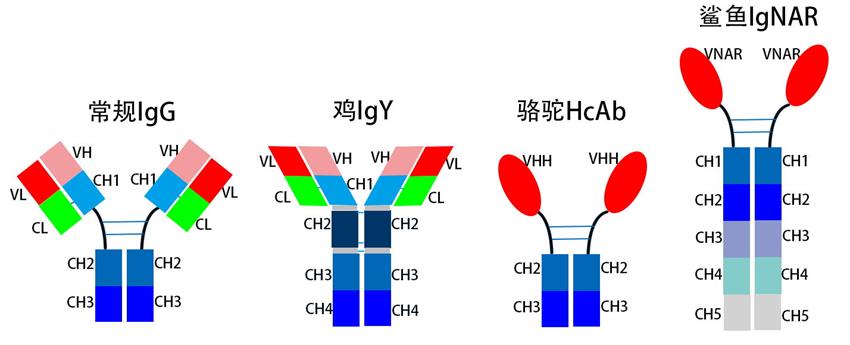
抗体的化学本质是免疫球蛋白,其单体结构由四条多肽链组成(两条重链和两条轻链)。常规的抗体分为五类(1gG,IgM,IgA,IgE,IgD),但由于遗传和进化方面的差异,各种动物的抗体类型有所不同,有的甚至差别很大,让我们一起走进动物的抗体世界。
卵黄中的精华—鸡的IgY抗体
鸡蛋不但具有较高的营养价值,而且含有丰富的免疫活性物质。1962年,英国剑桥大学的研究人员发现,免疫后的母鸡可以将血清中的抗体转移到卵黄中,这种抗体被称为卵黄抗体(immunoglobulin of yolk,IgY)。除IgY外,鸡体内还存在IgM和IgA类抗体,但没有发现IgE和IgD。
鸡的IgY在功能上与常规的IgG类似,但在分子结构上存在差异。与IgG相比,尽管IgY也是由两条重链(H链)和两条轻链(L链)组成,但IgY的重链没有铰链区,而是由1个可变区(V区)和4个恒定区(CH1~CH4)组成,而常规IgG只有3个恒定区(图1)。IgY分子中还含有丰富的疏水性分子,使其更适合“沉浸”于富含脂类的卵黄环境中。
由于IgY的化学性质稳定,生产相对方便,不需要动物采血,只需要收集鸡蛋就可以获得抗体,而且成本较低,已在人和动物的疾病诊断、药物及保健品开发等领域得到广泛应用。在诊断方面,由于结构上的差异,IgY不会与哺乳动物的Fc受体结合,也不会与哺乳动物来源的其他抗体发生交叉反应,这在免疫检测和诊断中具有重要意义;在免疫治疗方面,由于口服卵黄抗体制品通过胃肠道后仍保持较好的活性,国内外研究人员已开发出针对幽门螺旋杆菌、手足口病、肠道病毒以及激素、酶等上百种高效IgY抗体。美国FDA已批准卵黄抗体可以作为婴幼儿食品或中、老年人的保健食品添加剂。日本科学家通过从鸡蛋中提取抗变异链球菌的IgY抗体,将其添加到饮料、巧克力、干酪、软糖、可可块、雪糕和冰淇淋等食品中用于预防龋齿,相关产品已投放市场。此外,由于抗生素滥用严重,欧洲许多国家已提出禁止在动物饲料中添加抗生素,我国从2020年1月1日起,要求动物饲料中全面禁止使用抗生素,考虑到IgY在疾病预防和治疗方面的功能,这对IgY的研究和开发带来了新的机遇。
有“缺憾”的骆驼抗体
1989年,比利时科学家发现骆驼(单峰驼)血清中不仅存在由两条重链和两条轻链构成的IgG类常规抗体,同时还存在一种缺乏轻链、仅含重链的特殊抗体,称之为重链抗体(heavy-chain antibodies,HCAbs)。后来研究发现,HCAbs普遍存在于单峰驼、亚洲双峰驼、南美洲的大羊驼、原驼、羊驼等偶蹄目胼足亚目骆驼科动物的血清中。
HCAbs天然缺失轻链和CH1恒定区,其抗原结合位点仅由重链的可变区VHH(variable domain of the heavy chain)单结构域形成(图1),分子大小接近纳米级别,因此又被称为单域抗体或纳米抗体。研究发现,编码VHH的胚系基因与人IgG的VH基因II家族具有较高的同源性,VHH的表面大概只有10个氨基酸与人源VH不同,且VHH具有较长的互补决定区(complementarity-determining region,CDR)区,可以为抗原-抗体分子间的相互作用提供更大的接触表面。特别是其延伸的CDR3可形成凸出的环状结构,能够特异性识别并结合隐藏的抗原表位(如酶的活性中心等),而传统抗体Fab片段及单链抗体(single-chain variable fragment,scFv)通常只能识别位于抗原表面的位点。以上特点使HCAb在缺乏轻链的情况下仍具备广泛且较强的抗原结合能力。
与其他抗体相比,HCAbs的分子量相对较小(约15 KDa),而常规IgG的分子量约为150 KDa,单链抗体的分子量约30 KDa。小分子的HCAb具有更强的组织渗透力,更容易通过血脑屏障,再加上HCAbs易于表达和改造、水溶性好、稳定性强、免疫原性弱等特点,使得HCAbs在基础研究和药物开发等领域有着广阔的应用前景。美国Ablynx生物制药公司已用骆驼科动物研发了针对220种疾病的单域抗体。美国FDA批准的2019年第一款新药Cablivi(caplacizumab)即是一种二价抗血管性血友病因子的单域纳米抗体,这是一款用于治疗成人获得性血栓性血小板减少性紫癜(aTTP)的药物,此前已在欧盟获批。
“别致”的鲨鱼抗体IgNAR
有“海中狼”之称的鲨鱼是海洋中最凶猛的鱼类。由于鲨鱼具有超强的抗感染和抗癌能力,人们猜测鲨鱼体内一定存在某种神奇的免疫物质。科学家先后在鲨鱼体内发现了IgM和IgW。1995年,美国科学家又在铰口鲨(nurse shark)体内发现了一种新的抗体,该抗体与IgM和IgW不同,且与T细胞抗原受体同源性较高,同时具有免疫球蛋白的特性,因此将其命名为免疫球蛋白新抗原受体(Ig new antigen receptor,IgNAR) 。
与骆驼体内的HCAbs类似,IgNAR的分子量较小(12-15 kDa),并且缺乏轻链,但二者在结构上仍有不同之处。IgNAR是由两条重链构成的同源二聚体,在鲨鱼体内具有分泌型和膜结合型两种存在形式,其中分泌型IgNAR分子的重链包含1个可变区(VNAR)和5个恒定区(CH1~CH5)(图1)。VNAR的分子量仅为12 kDa左右,比VHH小约20%,是目前已知动物界最小的天然抗原结合域,其独特的分子特征也成为抗体试剂开发者关注的热点。
此外,IgNAR能够在含有350 mM尿素和1000 mOsm渗透压盐离子的鲨鱼血液中仍保持生物活性。除了稳定性好,IgNAR还具有亲和力高、可溶性好、组织穿透能力强、免疫原性低和易于人源化改造等优点,目前在疾病诊断、药物开发以及食品科学等领域受到广泛关注。
有“特长”的牛抗体
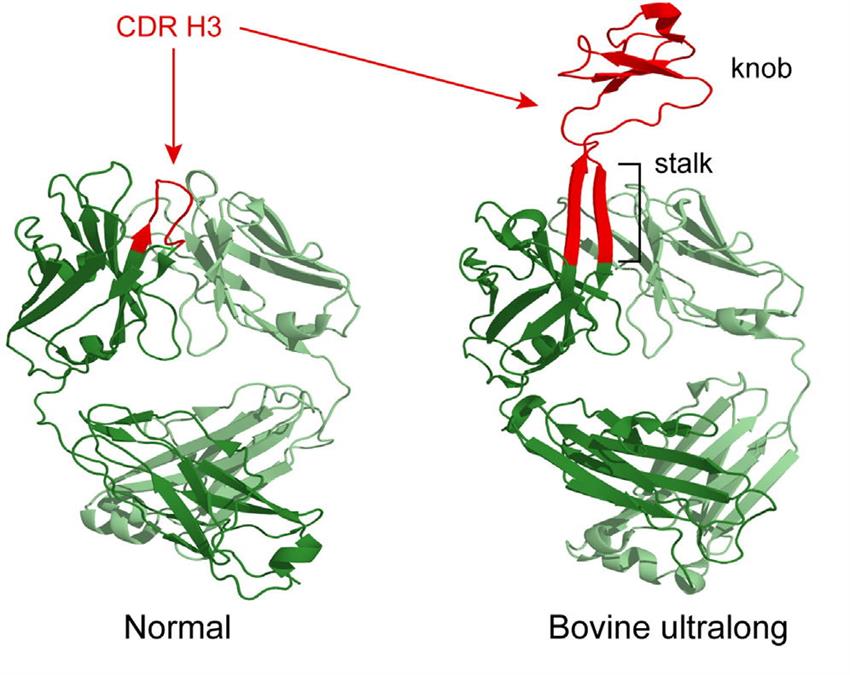
除了鸡的IgY、骆驼的HCAbs和鲨鱼的IgNAR异乎寻常外,研究人员在牛体内发现一种特殊的IgM抗体,该抗体具有超长的CDR H3区域(超过60个氨基酸),该区域由一个长长的“茎(stalk)”及其顶部二硫键形成的“圆球(knob)”构成(图2),这与常规的IgM或IgG抗体结构明显不同。牛的这种特殊抗体具有较强的抗原识别能力和较高的亲和力,成为牛抵抗病原体感染的关键“武器”。
科学家很想知道牛体内为什么能形成CDR H3这种独特的分子结构。美国科研团队对其编码序列进行了深入分析,并解析了其晶体结构,发现超长CDR H3上的“圆球”主要负责与抗原结合,其序列变化直接影响IgM结合抗原的种类和强度,作者推测这种超长CDR H3可能是牛为了抵御体内外病原微生物的威胁所形成。以上研究发表在2013年的《Cell》杂志上。2017年,美国斯克里普斯研究所的研究人员在《Nature》发文称,他们通过合成一种可以模拟HIV外壳的包膜蛋白,并将该蛋白免疫注射到4头奶牛体内,免疫后第42天,4头奶牛体内均产生了抗HIV的中和性抗体,而人群中大概只有1%的HIV感染者能产生这种抗体,而且一般需要在感染病毒5年之后才会产生。之前有研究人员曾在兔子和猴子身上开展类似研究,但均未能诱导出广谱的抗HIV中和性抗体。牛源抗体所具备的超长CDR H3区可能与形成抗HIV的广谱中和性抗体有关。这一研究表明,牛不但是研究艾滋病疫苗的理想工具。同时,也可作为研究其他复杂病原体中和性抗体的一种新型模式动物。
在漫长的生命演化过程中,动物的免疫系统趋向多样化和复杂化。目前人类所能认识到的动物抗体仍然十分有限,需要进一步探索更多的动物抗体资源,拓展对动物抗体的系统认识和科学利用。
当前,COVID-19对人类健康的威胁仍未结束,科学家一方面要对COVID-19的免疫机制开展深入的基础研究,同时应加大抗体药物的研发和应用。特别是利用现代分子生物学技术,结合卵黄抗体、纳米抗体及动物抗体的优势,研制更加精准的COVID-19诊断试剂和更加高效的抗体治疗药物,让动物抗体在这次抗击COVID-19疫情中更加“出彩”。
抗体的发现—诺贝尔生理学或医学奖的“首秀”
让我们先来看看抗体是怎么被发现的。1796年,英国乡村医生琴纳(Edward Jenner)发现接种牛痘可以预防天花,从此开创了免疫学发展的先河。19世纪,以法国化学家巴斯德(Louis Pasteur)和德国医生科霍(Robert Koch)为代表的科学家们证明了传染病的病原菌学说,并发明了多种病原的分离培养技术和疫苗。然而,受到当时科学水平的限制,人们并不清楚为什么打疫苗就能使人抵抗传染病?免疫系统又是如何发挥作用的?
1890年,德国Koch研究所的贝林(Emil Adolf von Behring)和日本的北里柴三郎在《德国医学周刊》发表文章,阐述了如何利用抗血清预防和治疗白喉及破伤风。他们最早将血清中的这种能中和毒素的因子称为抗毒素,即我们今天所说的抗体,从此拉开了抗体研究的大幕。
1901年,贝林因其在抗血清方面的研究贡献获得了第一届诺贝尔生理学或医学奖,这是诺贝尔奖开始颁发的第一年,也成为诺贝尔生理学或医学奖的“首秀”。
抗体的种类
抗体的化学本质是免疫球蛋白,其单体结构由四条多肽链组成(两条重链和两条轻链)。常规的抗体分为五类(1gG,IgM,IgA,IgE,IgD),但由于遗传和进化方面的差异,各种动物的抗体类型有所不同,有的甚至差别很大,让我们一起走进动物的抗体世界。
卵黄中的精华—鸡的IgY抗体
鸡蛋不但具有较高的营养价值,而且含有丰富的免疫活性物质。1962年,英国剑桥大学的研究人员发现,免疫后的母鸡可以将血清中的抗体转移到卵黄中,这种抗体被称为卵黄抗体(immunoglobulin of yolk,IgY)。除IgY外,鸡体内还存在IgM和IgA类抗体,但没有发现IgE和IgD。
鸡的IgY在功能上与常规的IgG类似,但在分子结构上存在差异。与IgG相比,尽管IgY也是由两条重链(H链)和两条轻链(L链)组成,但IgY的重链没有铰链区,而是由1个可变区(V区)和4个恒定区(CH1~CH4)组成,而常规IgG只有3个恒定区(图1)。IgY分子中还含有丰富的疏水性分子,使其更适合“沉浸”于富含脂类的卵黄环境中。
由于IgY的化学性质稳定,生产相对方便,不需要动物采血,只需要收集鸡蛋就可以获得抗体,而且成本较低,已在人和动物的疾病诊断、药物及保健品开发等领域得到广泛应用。在诊断方面,由于结构上的差异,IgY不会与哺乳动物的Fc受体结合,也不会与哺乳动物来源的其他抗体发生交叉反应,这在免疫检测和诊断中具有重要意义;在免疫治疗方面,由于口服卵黄抗体制品通过胃肠道后仍保持较好的活性,国内外研究人员已开发出针对幽门螺旋杆菌、手足口病、肠道病毒以及激素、酶等上百种高效IgY抗体。美国FDA已批准卵黄抗体可以作为婴幼儿食品或中、老年人的保健食品添加剂。日本科学家通过从鸡蛋中提取抗变异链球菌的IgY抗体,将其添加到饮料、巧克力、干酪、软糖、可可块、雪糕和冰淇淋等食品中用于预防龋齿,相关产品已投放市场。此外,由于抗生素滥用严重,欧洲许多国家已提出禁止在动物饲料中添加抗生素,我国从2020年1月1日起,要求动物饲料中全面禁止使用抗生素,考虑到IgY在疾病预防和治疗方面的功能,这对IgY的研究和开发带来了新的机遇。
有“缺憾”的骆驼抗体
1989年,比利时科学家发现骆驼(单峰驼)血清中不仅存在由两条重链和两条轻链构成的IgG类常规抗体,同时还存在一种缺乏轻链、仅含重链的特殊抗体,称之为重链抗体(heavy-chain antibodies,HCAbs)。后来研究发现,HCAbs普遍存在于单峰驼、亚洲双峰驼、南美洲的大羊驼、原驼、羊驼等偶蹄目胼足亚目骆驼科动物的血清中。
HCAbs天然缺失轻链和CH1恒定区,其抗原结合位点仅由重链的可变区VHH(variable domain of the heavy chain)单结构域形成(图1),分子大小接近纳米级别,因此又被称为单域抗体或纳米抗体。研究发现,编码VHH的胚系基因与人IgG的VH基因II家族具有较高的同源性,VHH的表面大概只有10个氨基酸与人源VH不同,且VHH具有较长的互补决定区(complementarity-determining region,CDR)区,可以为抗原-抗体分子间的相互作用提供更大的接触表面。特别是其延伸的CDR3可形成凸出的环状结构,能够特异性识别并结合隐藏的抗原表位(如酶的活性中心等),而传统抗体Fab片段及单链抗体(single-chain variable fragment,scFv)通常只能识别位于抗原表面的位点。以上特点使HCAb在缺乏轻链的情况下仍具备广泛且较强的抗原结合能力。
与其他抗体相比,HCAbs的分子量相对较小(约15 KDa),而常规IgG的分子量约为150 KDa,单链抗体的分子量约30 KDa。小分子的HCAb具有更强的组织渗透力,更容易通过血脑屏障,再加上HCAbs易于表达和改造、水溶性好、稳定性强、免疫原性弱等特点,使得HCAbs在基础研究和药物开发等领域有着广阔的应用前景。美国Ablynx生物制药公司已用骆驼科动物研发了针对220种疾病的单域抗体。美国FDA批准的2019年第一款新药Cablivi(caplacizumab)即是一种二价抗血管性血友病因子的单域纳米抗体,这是一款用于治疗成人获得性血栓性血小板减少性紫癜(aTTP)的药物,此前已在欧盟获批。
“别致”的鲨鱼抗体IgNAR
有“海中狼”之称的鲨鱼是海洋中最凶猛的鱼类。由于鲨鱼具有超强的抗感染和抗癌能力,人们猜测鲨鱼体内一定存在某种神奇的免疫物质。科学家先后在鲨鱼体内发现了IgM和IgW。1995年,美国科学家又在铰口鲨(nurse shark)体内发现了一种新的抗体,该抗体与IgM和IgW不同,且与T细胞抗原受体同源性较高,同时具有免疫球蛋白的特性,因此将其命名为免疫球蛋白新抗原受体(Ig new antigen receptor,IgNAR) 。
与骆驼体内的HCAbs类似,IgNAR的分子量较小(12-15 kDa),并且缺乏轻链,但二者在结构上仍有不同之处。IgNAR是由两条重链构成的同源二聚体,在鲨鱼体内具有分泌型和膜结合型两种存在形式,其中分泌型IgNAR分子的重链包含1个可变区(VNAR)和5个恒定区(CH1~CH5)(图1)。VNAR的分子量仅为12 kDa左右,比VHH小约20%,是目前已知动物界最小的天然抗原结合域,其独特的分子特征也成为抗体试剂开发者关注的热点。
此外,IgNAR能够在含有350 mM尿素和1000 mOsm渗透压盐离子的鲨鱼血液中仍保持生物活性。除了稳定性好,IgNAR还具有亲和力高、可溶性好、组织穿透能力强、免疫原性低和易于人源化改造等优点,目前在疾病诊断、药物开发以及食品科学等领域受到广泛关注。

图1 不同动物抗体结构模式图
有“特长”的牛抗体
除了鸡的IgY、骆驼的HCAbs和鲨鱼的IgNAR异乎寻常外,研究人员在牛体内发现一种特殊的IgM抗体,该抗体具有超长的CDR H3区域(超过60个氨基酸),该区域由一个长长的“茎(stalk)”及其顶部二硫键形成的“圆球(knob)”构成(图2),这与常规的IgM或IgG抗体结构明显不同。牛的这种特殊抗体具有较强的抗原识别能力和较高的亲和力,成为牛抵抗病原体感染的关键“武器”。
科学家很想知道牛体内为什么能形成CDR H3这种独特的分子结构。美国科研团队对其编码序列进行了深入分析,并解析了其晶体结构,发现超长CDR H3上的“圆球”主要负责与抗原结合,其序列变化直接影响IgM结合抗原的种类和强度,作者推测这种超长CDR H3可能是牛为了抵御体内外病原微生物的威胁所形成。以上研究发表在2013年的《Cell》杂志上。2017年,美国斯克里普斯研究所的研究人员在《Nature》发文称,他们通过合成一种可以模拟HIV外壳的包膜蛋白,并将该蛋白免疫注射到4头奶牛体内,免疫后第42天,4头奶牛体内均产生了抗HIV的中和性抗体,而人群中大概只有1%的HIV感染者能产生这种抗体,而且一般需要在感染病毒5年之后才会产生。之前有研究人员曾在兔子和猴子身上开展类似研究,但均未能诱导出广谱的抗HIV中和性抗体。牛源抗体所具备的超长CDR H3区可能与形成抗HIV的广谱中和性抗体有关。这一研究表明,牛不但是研究艾滋病疫苗的理想工具。同时,也可作为研究其他复杂病原体中和性抗体的一种新型模式动物。

图2 牛抗体中的CDR H3 “特长”结构(来自Haakenson, et al 2018)
在漫长的生命演化过程中,动物的免疫系统趋向多样化和复杂化。目前人类所能认识到的动物抗体仍然十分有限,需要进一步探索更多的动物抗体资源,拓展对动物抗体的系统认识和科学利用。
当前,COVID-19对人类健康的威胁仍未结束,科学家一方面要对COVID-19的免疫机制开展深入的基础研究,同时应加大抗体药物的研发和应用。特别是利用现代分子生物学技术,结合卵黄抗体、纳米抗体及动物抗体的优势,研制更加精准的COVID-19诊断试剂和更加高效的抗体治疗药物,让动物抗体在这次抗击COVID-19疫情中更加“出彩”。
河南科技学院动物科技学院 李任峰
上一篇:天然免疫细胞在抗菌防御中的作用
下一篇:炎症因子风暴
