学术动态
曹雪涛团队《Immunity》提出靶向肿瘤细胞巨胞饮的新型免疫治疗途径
作者:王羽佳 来源自:中国免疫学会 点击数:6944 发布时间:2025-08-26
在营养物质丰富的情况下,细胞能够通过脂膜转运的方式获得氨基酸,满足自身生长的营养需求。但在营养匮乏的微环境,肿瘤细胞需要通过巨胞饮途径摄取细胞外空间的蛋白质,在溶酶体分解构成新的氨基酸来源。巨胞饮是一种不依赖网格蛋白的内吞形式,能够非选择性摄取细胞外的蛋白、糖和脂质。RAS突变是最早被发现的巨胞饮驱动因素,但后续研究对巨胞饮启动过程关键基因的发掘并不深入。巨胞饮经常作为病毒和细菌入侵宿主细胞的途径,但并无研究表明肿瘤细胞能够利用该途径逃避宿主的免疫监视,肿瘤细胞巨胞饮的水平与免疫治疗效果之间的关联也不明确。
限制肿瘤本身的代谢一直是治疗快速增殖肿瘤的思路,但在体外实验获得疗效的策略往往在体内失效,很可能是因为肿瘤通过巨胞饮等途径从体内微环境中获得了营养补充。目前只有少量研究靶向巨胞饮杀伤肿瘤,原因可能是现有研究对巨胞饮的调控机制并不明确。因此,发现新的巨胞饮调控元件可以为肿瘤治疗提供新的思路。
2025年8月14日,曹雪涛院士团队在《Immunity》杂志发表题为“Inhibition of tumor cell macropinocytosis driver DHODH reverses immunosuppression and overcomes anti-PD1 resistance”的论文,该研究揭示了二氢乳清酸脱氢酶DHODH促进肿瘤巨胞饮及免疫逃逸的新机制,并进一步提出靶向抑制DHODH可以提升肿瘤细胞的免疫原性以及免疫检查点PD-1抗体的疗效。
首先,该研究通过代谢化合物库结合高内涵成像平台,以及全基因组CRISPR-Cas9文库的双重筛选,锁定DHODH作为研究对象。两种DHODH的抑制剂BAY-2402234和Brequinar(BRQ)处理均能显著抑制人和小鼠的肺癌、肠癌、乳腺癌、胰腺癌细胞系的巨胞饮水平,证明其作用的广泛性。同时抑制剂能够在乳腺癌,肺癌小鼠模型的体内抑制肿瘤的巨胞饮和生长。
鉴于DHODH是嘧啶从头合成途径的第四个限速酶,可能从代谢的层面调控巨胞饮。非靶向代谢组学显示BRQ影响肿瘤的鞘脂、磷脂代谢途径,提示DHODH可能影响肿瘤细胞膜的构成。提取膜蛋白进行质谱检测,发现多种促进巨胞饮的蛋白在BRQ处理后减少。比如AXL、EGFR、SRC这些基因已经被证明在肿瘤获取营养、病毒入侵宿主、免疫细胞摄取病原体等生命活动中促进巨胞饮。其中神经纤毛蛋白-1(NRP1)在多种类型的肿瘤细胞中均表现出显著的膜定位下降。NRP1作为VEGF、TGF-β、HGF等多种生长因子的共受体在血管生成等多个生命过程中发挥重要作用。目前围绕NRP1的研究主要集中在促进Treg发挥免疫抑制功能,而针对它在肿瘤内的功能研究较少。有研究表示NRP1能够辅助EB病毒通过巨胞饮途径入侵鼻咽上皮细胞,作者使用NRP1的特异性抑制剂EG01377,证明NRP1能够促进多种肿瘤细胞的巨胞饮。
由于NRP1本身是一种糖蛋白,而DHODH参与的嘧啶代谢与糖类息息相关。代谢组学结果显示,DHODH下游的代谢产物例如三磷酸尿苷(UTP)在BRQ处理后显著下降,以UTP为原料的一系列核苷酸糖均减少。其中尿苷二磷酸-N-乙酰基葡萄糖胺(UDP-GlcNAc)是O-糖基化修饰的直接糖供体,抑制DHODH能够减弱肿瘤细胞总体糖基化的水平。O-糖基化修饰受到转移酶OGT和去修饰酶OGA的循环调控。OGT的抑制剂OSMI-1能够下调NRP1的膜定位,同时抑制肿瘤细胞的巨胞饮,OGA的抑制剂Thiamet G获得相反的表型,表明DHODH通过O-糖基化途径维持NRP1的膜定位,促进肿瘤的巨胞饮。O-糖基化的泛抗体证实NRP1存在该修饰且受到DHODH的调控。通过质谱鉴定出NRP1在827/830位苏氨酸,829位丝氨酸位点存在O-糖基化修饰。点突变实验证实这三个位点对于肿瘤细胞的巨胞饮以及维持NRP1的膜定位至关重要。
肿瘤细胞可以通过自噬途径选择性降解MHC-I,促进肿瘤的免疫逃逸。然而,目前为止并没有研究探讨巨胞饮和肿瘤免疫逃逸之间的关联。RNA-Seq结果显示,使用BRQ能够显著上调肿瘤细胞主要组织相容性复合体MHC-II类分子,该作用依赖DHODH对巨胞饮的促进作用。巨胞饮的抑制剂EIPA能够显著抑制荷瘤小鼠肿瘤的生长,增强肿瘤细胞MHC-II类分子的转录,同时招募更多的CD4+、CD8+ T细胞浸润到肿瘤内。以往的研究主要关注免疫细胞表达的MHC-II类分子,少量研究在临床样本中检测肿瘤MHC-II类分子的阳性率与患者接受PD-1/PD-L1 抗体治疗的响应性、生存率以及CD4+、CD8+ T细胞的浸润呈正相关。MHC-II类分子的转录主要受到II类反式激活因子CIITA的调控,质谱鉴定肿瘤细胞的CIITA在120位的赖氨酸位点存在戊二酰化修饰。荧光素酶报告基因实验证明该修饰会抑制CIITA的转录激活能力。必需氨基酸赖氨酸和色氨酸是戊二酰化修饰供体戊二酰辅酶A的上游代谢物,DHODH驱动的巨胞饮能让肿瘤细胞摄取更多的赖氨酸和色氨酸,增加CIITA的戊二酰化,抑制肿瘤MHC-II类基因的转录,实现免疫逃逸。
阻断CTLA4、PD-1、PD-L1等检查点的治疗方案已经在临床上得到了广泛应用,但只有10-30%的肿瘤患者对治疗表现出持续的响应。乳腺癌是一种公认的冷肿瘤,对于PD-1抗体的单独治疗几乎不响应,研究人员使用BRQ与PD-1抗体联合治疗4T1荷瘤小鼠,发现单独使用BRQ具有一定的治疗作用,而联用组可以显著增强疗效。质谱流式检测发现BRQ治疗能够上调肿瘤细胞表面MHC-II类分子的表达,并且在联合治疗组的上调更加显著。瘤内浸润的CD8+ T、CD4+ T和NK细胞在联合治疗后升高。细胞毒性CD8+ T 和 NK细胞分泌的颗粒酶B、穿孔素、IFN-γ等细胞杀伤因子也在联合治疗组的肿瘤内富集,对肿瘤进行杀伤。
为了证明本研究具有临床转化意义,研究人员在肺癌和乳腺癌的组织芯片中检测几个靶点的表达。免疫组化的结果显示:瘤内高表达DHODH、NRP1或低表达CD74的患者具有更短的生存期。同时DHODH的含量和NRP1的膜定位呈正相关,与CD74的表达以及T细胞的瘤内浸润呈负相关。在接受检查点阻断治疗的肺癌患者样品中,肿瘤内DHODH和NRP1的表达水平与患者对治疗的响应性呈负相关,而CD74的含量在治疗响应组更高。
综上,该研究发现了新的肿瘤巨胞饮驱动元件:DHODH。当肿瘤细胞处于营养匮乏状态,DHODH通过代谢途径维持NRP1的O-糖基化修饰及膜定位,促进肿瘤细胞的巨胞饮。更重要的是,该研究首次将巨胞饮这一肿瘤生物学过程与免疫细胞对肿瘤的监视和杀伤关联起来,发现肿瘤通过巨胞饮摄取更多的赖氨酸、色氨酸上调CIITA的戊二酰化水平,抑制肿瘤内源性MHC-II类分子的转录,最终实现免疫逃逸。使用抑制剂或敲除肿瘤细胞内的DHODH能够显著抑制荷瘤小鼠肿瘤的生长,通过增强肿瘤的免疫原性招募更多免疫细胞浸润肿瘤微环境,有效逆转肿瘤对PD-1抗体治疗的抵抗,该研究为肿瘤的免疫治疗提供新的思路。
肿瘤代谢是近些年的研究热点,肿瘤自身的代谢可以通过营养竞争,分泌代谢物,改变微环境中的氧含量、酸度等途径削弱免疫细胞的免疫监视功能。同时免疫治疗可以改变肿瘤的代谢状态,例如肿瘤细胞通过争夺微环境中的葡萄糖限制T细胞肿瘤杀伤功能,免疫检查点阻断治疗可以部分恢复微环境中的葡萄糖含量及T细胞功能。肿瘤的代谢重编程还可以募集更多发挥免疫抑制功能的细胞亚群,如肿瘤相关巨噬细胞(TAM)和髓系来源的抑制性细胞(MDSC)进入微环境。巨胞饮可以将肿瘤内部的代谢状态与微环境中的免疫细胞联系起来。例如,肿瘤可以通过巨胞饮摄取中性粒细胞来源的脂质。本研究首次探讨了巨胞饮与肿瘤免疫治疗效果之间的关联,同时揭示了代谢相关翻译后修饰作为肿瘤治疗靶点的巨大潜力。然而,目前并没有靶向巨胞饮药物进入肿瘤临床试验,而DHODH的抑制剂BAY-2402234已作为白血病的治疗手段进行了临床实验,而另一种DHODH的抑制剂Leflunomide已作为临床用药治疗类风湿关节炎等自身免疫病。因此,DHODH抑制剂在人体内的安全性能够得到保证,有望作为巨胞饮的抑制剂用于临床治疗。
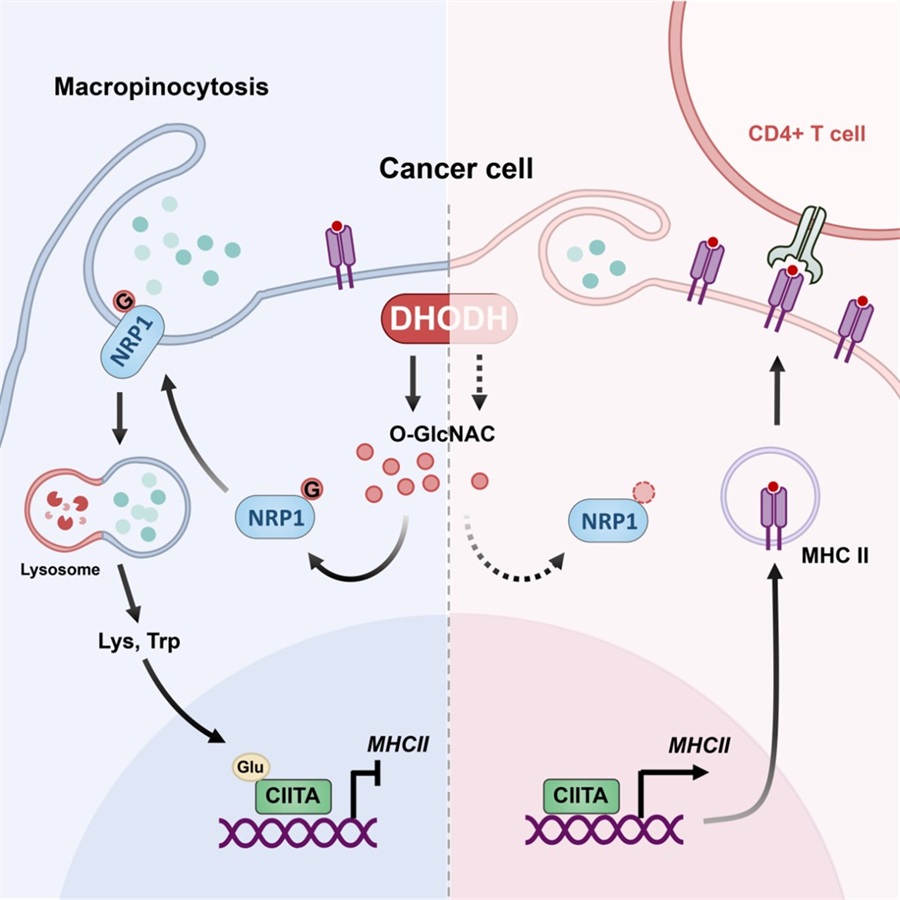
抑制DHODH介导的巨胞饮提高肿瘤细胞的免疫原性
本研究工作得到了国家自然科学基金、中国医学科学院医学与健康科技创新工程项目、博士后创新人才支持计划等项目的资助。中国医学科学院曹雪涛院士为论文通讯作者,助理研究员王羽佳为第一作者。
论文链接:https://www.sciencedirect.com/science/article/pii/S107476132500322X
限制肿瘤本身的代谢一直是治疗快速增殖肿瘤的思路,但在体外实验获得疗效的策略往往在体内失效,很可能是因为肿瘤通过巨胞饮等途径从体内微环境中获得了营养补充。目前只有少量研究靶向巨胞饮杀伤肿瘤,原因可能是现有研究对巨胞饮的调控机制并不明确。因此,发现新的巨胞饮调控元件可以为肿瘤治疗提供新的思路。
2025年8月14日,曹雪涛院士团队在《Immunity》杂志发表题为“Inhibition of tumor cell macropinocytosis driver DHODH reverses immunosuppression and overcomes anti-PD1 resistance”的论文,该研究揭示了二氢乳清酸脱氢酶DHODH促进肿瘤巨胞饮及免疫逃逸的新机制,并进一步提出靶向抑制DHODH可以提升肿瘤细胞的免疫原性以及免疫检查点PD-1抗体的疗效。
首先,该研究通过代谢化合物库结合高内涵成像平台,以及全基因组CRISPR-Cas9文库的双重筛选,锁定DHODH作为研究对象。两种DHODH的抑制剂BAY-2402234和Brequinar(BRQ)处理均能显著抑制人和小鼠的肺癌、肠癌、乳腺癌、胰腺癌细胞系的巨胞饮水平,证明其作用的广泛性。同时抑制剂能够在乳腺癌,肺癌小鼠模型的体内抑制肿瘤的巨胞饮和生长。
鉴于DHODH是嘧啶从头合成途径的第四个限速酶,可能从代谢的层面调控巨胞饮。非靶向代谢组学显示BRQ影响肿瘤的鞘脂、磷脂代谢途径,提示DHODH可能影响肿瘤细胞膜的构成。提取膜蛋白进行质谱检测,发现多种促进巨胞饮的蛋白在BRQ处理后减少。比如AXL、EGFR、SRC这些基因已经被证明在肿瘤获取营养、病毒入侵宿主、免疫细胞摄取病原体等生命活动中促进巨胞饮。其中神经纤毛蛋白-1(NRP1)在多种类型的肿瘤细胞中均表现出显著的膜定位下降。NRP1作为VEGF、TGF-β、HGF等多种生长因子的共受体在血管生成等多个生命过程中发挥重要作用。目前围绕NRP1的研究主要集中在促进Treg发挥免疫抑制功能,而针对它在肿瘤内的功能研究较少。有研究表示NRP1能够辅助EB病毒通过巨胞饮途径入侵鼻咽上皮细胞,作者使用NRP1的特异性抑制剂EG01377,证明NRP1能够促进多种肿瘤细胞的巨胞饮。
由于NRP1本身是一种糖蛋白,而DHODH参与的嘧啶代谢与糖类息息相关。代谢组学结果显示,DHODH下游的代谢产物例如三磷酸尿苷(UTP)在BRQ处理后显著下降,以UTP为原料的一系列核苷酸糖均减少。其中尿苷二磷酸-N-乙酰基葡萄糖胺(UDP-GlcNAc)是O-糖基化修饰的直接糖供体,抑制DHODH能够减弱肿瘤细胞总体糖基化的水平。O-糖基化修饰受到转移酶OGT和去修饰酶OGA的循环调控。OGT的抑制剂OSMI-1能够下调NRP1的膜定位,同时抑制肿瘤细胞的巨胞饮,OGA的抑制剂Thiamet G获得相反的表型,表明DHODH通过O-糖基化途径维持NRP1的膜定位,促进肿瘤的巨胞饮。O-糖基化的泛抗体证实NRP1存在该修饰且受到DHODH的调控。通过质谱鉴定出NRP1在827/830位苏氨酸,829位丝氨酸位点存在O-糖基化修饰。点突变实验证实这三个位点对于肿瘤细胞的巨胞饮以及维持NRP1的膜定位至关重要。
肿瘤细胞可以通过自噬途径选择性降解MHC-I,促进肿瘤的免疫逃逸。然而,目前为止并没有研究探讨巨胞饮和肿瘤免疫逃逸之间的关联。RNA-Seq结果显示,使用BRQ能够显著上调肿瘤细胞主要组织相容性复合体MHC-II类分子,该作用依赖DHODH对巨胞饮的促进作用。巨胞饮的抑制剂EIPA能够显著抑制荷瘤小鼠肿瘤的生长,增强肿瘤细胞MHC-II类分子的转录,同时招募更多的CD4+、CD8+ T细胞浸润到肿瘤内。以往的研究主要关注免疫细胞表达的MHC-II类分子,少量研究在临床样本中检测肿瘤MHC-II类分子的阳性率与患者接受PD-1/PD-L1 抗体治疗的响应性、生存率以及CD4+、CD8+ T细胞的浸润呈正相关。MHC-II类分子的转录主要受到II类反式激活因子CIITA的调控,质谱鉴定肿瘤细胞的CIITA在120位的赖氨酸位点存在戊二酰化修饰。荧光素酶报告基因实验证明该修饰会抑制CIITA的转录激活能力。必需氨基酸赖氨酸和色氨酸是戊二酰化修饰供体戊二酰辅酶A的上游代谢物,DHODH驱动的巨胞饮能让肿瘤细胞摄取更多的赖氨酸和色氨酸,增加CIITA的戊二酰化,抑制肿瘤MHC-II类基因的转录,实现免疫逃逸。
阻断CTLA4、PD-1、PD-L1等检查点的治疗方案已经在临床上得到了广泛应用,但只有10-30%的肿瘤患者对治疗表现出持续的响应。乳腺癌是一种公认的冷肿瘤,对于PD-1抗体的单独治疗几乎不响应,研究人员使用BRQ与PD-1抗体联合治疗4T1荷瘤小鼠,发现单独使用BRQ具有一定的治疗作用,而联用组可以显著增强疗效。质谱流式检测发现BRQ治疗能够上调肿瘤细胞表面MHC-II类分子的表达,并且在联合治疗组的上调更加显著。瘤内浸润的CD8+ T、CD4+ T和NK细胞在联合治疗后升高。细胞毒性CD8+ T 和 NK细胞分泌的颗粒酶B、穿孔素、IFN-γ等细胞杀伤因子也在联合治疗组的肿瘤内富集,对肿瘤进行杀伤。
为了证明本研究具有临床转化意义,研究人员在肺癌和乳腺癌的组织芯片中检测几个靶点的表达。免疫组化的结果显示:瘤内高表达DHODH、NRP1或低表达CD74的患者具有更短的生存期。同时DHODH的含量和NRP1的膜定位呈正相关,与CD74的表达以及T细胞的瘤内浸润呈负相关。在接受检查点阻断治疗的肺癌患者样品中,肿瘤内DHODH和NRP1的表达水平与患者对治疗的响应性呈负相关,而CD74的含量在治疗响应组更高。
综上,该研究发现了新的肿瘤巨胞饮驱动元件:DHODH。当肿瘤细胞处于营养匮乏状态,DHODH通过代谢途径维持NRP1的O-糖基化修饰及膜定位,促进肿瘤细胞的巨胞饮。更重要的是,该研究首次将巨胞饮这一肿瘤生物学过程与免疫细胞对肿瘤的监视和杀伤关联起来,发现肿瘤通过巨胞饮摄取更多的赖氨酸、色氨酸上调CIITA的戊二酰化水平,抑制肿瘤内源性MHC-II类分子的转录,最终实现免疫逃逸。使用抑制剂或敲除肿瘤细胞内的DHODH能够显著抑制荷瘤小鼠肿瘤的生长,通过增强肿瘤的免疫原性招募更多免疫细胞浸润肿瘤微环境,有效逆转肿瘤对PD-1抗体治疗的抵抗,该研究为肿瘤的免疫治疗提供新的思路。
肿瘤代谢是近些年的研究热点,肿瘤自身的代谢可以通过营养竞争,分泌代谢物,改变微环境中的氧含量、酸度等途径削弱免疫细胞的免疫监视功能。同时免疫治疗可以改变肿瘤的代谢状态,例如肿瘤细胞通过争夺微环境中的葡萄糖限制T细胞肿瘤杀伤功能,免疫检查点阻断治疗可以部分恢复微环境中的葡萄糖含量及T细胞功能。肿瘤的代谢重编程还可以募集更多发挥免疫抑制功能的细胞亚群,如肿瘤相关巨噬细胞(TAM)和髓系来源的抑制性细胞(MDSC)进入微环境。巨胞饮可以将肿瘤内部的代谢状态与微环境中的免疫细胞联系起来。例如,肿瘤可以通过巨胞饮摄取中性粒细胞来源的脂质。本研究首次探讨了巨胞饮与肿瘤免疫治疗效果之间的关联,同时揭示了代谢相关翻译后修饰作为肿瘤治疗靶点的巨大潜力。然而,目前并没有靶向巨胞饮药物进入肿瘤临床试验,而DHODH的抑制剂BAY-2402234已作为白血病的治疗手段进行了临床实验,而另一种DHODH的抑制剂Leflunomide已作为临床用药治疗类风湿关节炎等自身免疫病。因此,DHODH抑制剂在人体内的安全性能够得到保证,有望作为巨胞饮的抑制剂用于临床治疗。

抑制DHODH介导的巨胞饮提高肿瘤细胞的免疫原性
本研究工作得到了国家自然科学基金、中国医学科学院医学与健康科技创新工程项目、博士后创新人才支持计划等项目的资助。中国医学科学院曹雪涛院士为论文通讯作者,助理研究员王羽佳为第一作者。
论文链接:https://www.sciencedirect.com/science/article/pii/S107476132500322X
