学术动态
清华大学朱可可团队/西湖大学徐和平团队合作在《Immunity》发表封面文章揭示肠神经-ILC2互作新机制
作者:张效禹 来源自:中国免疫学会 点击数:14231 发布时间:2025-02-18
肠道是人体免疫系统最大的组成部分,包含大量的淋巴组织和散布其中的免疫细胞。2型固有淋巴样细胞(group 2 innate lymphoid cells, ILC2s)作为肠道重要的先天性免疫细胞群体,能够产生IL-5和IL-13等2型细胞因子,调节过敏反应、组织修复以及抗蠕虫免疫。研究表明,神经递质和神经肽在ILC2介导的免疫反应中发挥着重要作用:神经肽U(NMU)、乙酰胆碱(ACh)和血管活性肠肽(VIP)等可以促进ILC2的免疫反应,而降钙素基因相关肽(CGRP)等则抑制其活性。肠神经系统(enteric nervous system, ENS)是由大量神经元和胶质细胞组成的复杂网络。ENS神经元数量是脊髓的五倍,因此常被称为“第二大脑”。肠道内在神经元(intrinsic enteric neuron, iEN)的胞体位于肠道内,能够形成独特的神经回路,展现出自主反射的活动。此外,胞体在肠道外的外源性肠神经也在肠道功能中发挥作用,例如位于背根神经节(DRG)中的感觉神经元,和位于腹腔-肠系膜上神经节(CG-SMG)中的交感神经元。
尽管关于肠道免疫系统与外源性肠神经之间的相互作用已有大量研究,但肠道免疫系统与肠道内在神经元之间的相互作用尚未得到充分阐明。比如,肠道内在神经元具体是如何感知肠道免疫微环境的变化进而释放上述各种具有免疫调节功能的神经信号分子这一核心科学问题还不清晰。
2025年1月30日,清华大学基础医学院免疫学研究所朱可可课题组与西湖大学医学院徐和平课题组在《Immunity》杂志上在线发表题为“Bi-directional communication between intrinsic enteric neurons and ILC2s inhibits host defense against helminth infection”的研究论文,揭示了在蠕虫感染过程中,ILC2产生的IL-13会使iEN发生活化,上调β-CGRP的表达,从而抑制ILC2介导的抗蠕虫免疫反应。
在这项研究中,研究人员发现蠕虫感染会激活肠道内在神经元。同时,通过单细胞核RNA测序(snRNA-seq)分析揭示肠道内在神经元的亚群—内在初级传入神经元(intrinsic primary afferent neuron 1, IPAN1)的转录组状态发生了特异性的改变,其中包括Il13ra1和Calcb(编码β-CGRP)基因表达水平上调。
进一步研究表明,IL-13刺激能够直接诱导肠道内在神经元的活化,而ILC2作为蠕虫感染期间IL-13的主要来源,在促进肠道内在神经元活化的过程中发挥了至关重要的作用。研究人员特别关注了这些表达IL13RA1受体的神经元,发现这些神经元能够直接响应IL-13信号,导致转录组的变化,特别是上调了Calcb基因的表达。β-CGRP是一种已知的负调控因子,它的增加直接抑制了ILC2的抗蠕虫免疫反应。
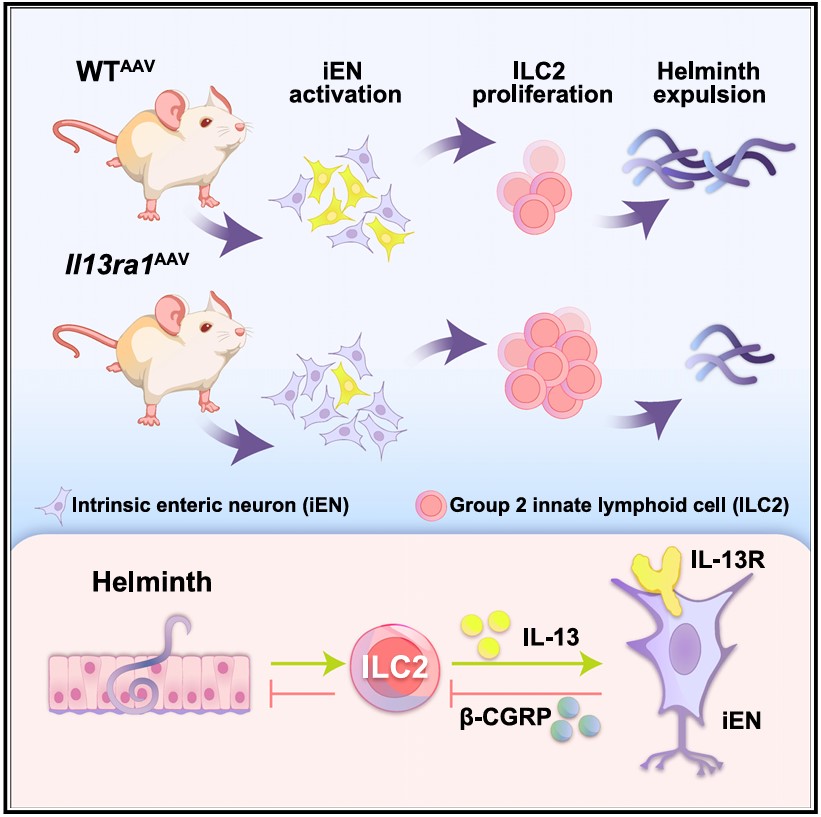
综上所述,此研究揭示了肠道内在神经元通过表达IL13RA1分子可直接被ILC2产生的IL-13激活来上调神经肽β-CGRP的表达,进而抑制ILC2的增殖和蠕虫的排出等,在抗寄生虫免疫中发挥了重要的负调控作用。这一发现为肠道免疫反应与神经系统之间的相互作用提供了新的视角,并为未来调节2型炎症提供了潜在的分子靶点。《Immunity》为本研究配以题为“Nerve-racking worms”的专文评述。
清华大学基础医学院助理教授、免疫学研究所研究员朱可可与西湖大学医学院研究员徐和平为本文的共同通讯作者。西湖大学-复旦大学2020级联合培养博士生王寅生和清华大学基础医学院2021级博士生张效禹为本文的共同第一作者。西湖大学2019级博士生臧扬在项目早期做出了重要的奠基性工作。该研究得到了清华大学祁海教授、吴励教授、胡小玉教授、郭晓欢副教授,上海市免疫治疗创新研究院周磊研究员,中山大学附属第一医院王芳教授,西湖大学何丹阳研究员的大力支持。
原文链接:https://www.cell.com/immunity/fulltext/S1074-7613(25)00029-9
课题组简介
清华大学基础医学院朱可可实验室聚焦于解析共生菌群、免疫系统和神经系统三者之间的相互作用,始终致力于探索以前未被识别的神经—免疫回路,揭示潜在的分子机制,为开发新的疾病防治策略提供实验证据支持,相关工作发表于Immunity(2025,封面文章)、Journal of Allergy and Clinical Immunology(2024)、Science immunology(2021)、Nature(2019)等。实验室主页请见https://www.cocochu-lab.org/。
尽管关于肠道免疫系统与外源性肠神经之间的相互作用已有大量研究,但肠道免疫系统与肠道内在神经元之间的相互作用尚未得到充分阐明。比如,肠道内在神经元具体是如何感知肠道免疫微环境的变化进而释放上述各种具有免疫调节功能的神经信号分子这一核心科学问题还不清晰。
2025年1月30日,清华大学基础医学院免疫学研究所朱可可课题组与西湖大学医学院徐和平课题组在《Immunity》杂志上在线发表题为“Bi-directional communication between intrinsic enteric neurons and ILC2s inhibits host defense against helminth infection”的研究论文,揭示了在蠕虫感染过程中,ILC2产生的IL-13会使iEN发生活化,上调β-CGRP的表达,从而抑制ILC2介导的抗蠕虫免疫反应。

在这项研究中,研究人员发现蠕虫感染会激活肠道内在神经元。同时,通过单细胞核RNA测序(snRNA-seq)分析揭示肠道内在神经元的亚群—内在初级传入神经元(intrinsic primary afferent neuron 1, IPAN1)的转录组状态发生了特异性的改变,其中包括Il13ra1和Calcb(编码β-CGRP)基因表达水平上调。
进一步研究表明,IL-13刺激能够直接诱导肠道内在神经元的活化,而ILC2作为蠕虫感染期间IL-13的主要来源,在促进肠道内在神经元活化的过程中发挥了至关重要的作用。研究人员特别关注了这些表达IL13RA1受体的神经元,发现这些神经元能够直接响应IL-13信号,导致转录组的变化,特别是上调了Calcb基因的表达。β-CGRP是一种已知的负调控因子,它的增加直接抑制了ILC2的抗蠕虫免疫反应。

综上所述,此研究揭示了肠道内在神经元通过表达IL13RA1分子可直接被ILC2产生的IL-13激活来上调神经肽β-CGRP的表达,进而抑制ILC2的增殖和蠕虫的排出等,在抗寄生虫免疫中发挥了重要的负调控作用。这一发现为肠道免疫反应与神经系统之间的相互作用提供了新的视角,并为未来调节2型炎症提供了潜在的分子靶点。《Immunity》为本研究配以题为“Nerve-racking worms”的专文评述。
清华大学基础医学院助理教授、免疫学研究所研究员朱可可与西湖大学医学院研究员徐和平为本文的共同通讯作者。西湖大学-复旦大学2020级联合培养博士生王寅生和清华大学基础医学院2021级博士生张效禹为本文的共同第一作者。西湖大学2019级博士生臧扬在项目早期做出了重要的奠基性工作。该研究得到了清华大学祁海教授、吴励教授、胡小玉教授、郭晓欢副教授,上海市免疫治疗创新研究院周磊研究员,中山大学附属第一医院王芳教授,西湖大学何丹阳研究员的大力支持。
原文链接:https://www.cell.com/immunity/fulltext/S1074-7613(25)00029-9
课题组简介
清华大学基础医学院朱可可实验室聚焦于解析共生菌群、免疫系统和神经系统三者之间的相互作用,始终致力于探索以前未被识别的神经—免疫回路,揭示潜在的分子机制,为开发新的疾病防治策略提供实验证据支持,相关工作发表于Immunity(2025,封面文章)、Journal of Allergy and Clinical Immunology(2024)、Science immunology(2021)、Nature(2019)等。实验室主页请见https://www.cocochu-lab.org/。
