学术动态
清华大学刘万里与合作者揭示IgG抗体稳态调控新机制及其在红斑狼疮发病和治疗中的潜在价值
作者:刘万里 来源自:中国免疫学会 点击数:8560 发布时间:2024-11-08
2024年10月29日,清华大学生命学院、CLS生命中心、免疫学研究所、膜生物学全国重点实验室、教育部蛋白质科学重点实验室的刘万里与合作者在国际免疫学顶级期刊《Immunity》发表研究论文“Progressive polyadenylation and m6A modification of Ighg1 mRNA maintain IgG1 antibody homeostasis in antibody-secreting cells”,揭示IgG抗体稳态调控的新机制,并探索其在自身免疫疾病的发病和治疗中的潜在价值。
两千五百年前,古希腊的修昔底德(Thucydides)曾经这样描述公元前430年雅典城的一场瘟疫:“染病而垂死的病人,只能被那些已经染病但侥幸康复的人照顾。这些康复者虽然每天照料染病者,但对此并不担心,因为他们了解瘟疫的特征和进程。的确,他们很清楚,在这次瘟疫中,幸存者将不会被瘟疫第二次感染,至少不会因此丧命”。
两千五百年后,现代免疫学研究才逐渐的解析了其中的基本生物医学原理:病原体感染机体后,初始型B细胞(Mature naïve B cell)产生抗体抵御病原体;康复者获得记忆性B细胞,此类B细胞承载IgG抗体记忆,遇到相同病原体时快速免疫活化并产生IgG型的病原体特异性抗体,从而有效抵御病原体的致命攻击。凭借这一生物医学基本原理,人类已经清除天花病毒,接近根除脊髓灰质炎病毒,并有效控制了如麻疹、流脑、白喉等恶性传染病。尽管取得了巨大进展,人类对IgG抗体的稳态维持机制仍然缺乏深入了解。这一科学问题在临床免疫学研究的自身免疫紊乱等方面疾病尤为重要,例如系统性红斑狼疮(Systemic lupus erythematosus, SLE),SLE患者通常表现为异常的免疫应答,其体内的自身反应性B细胞打破免疫耐受,分化为浆细胞而产生过多的IgG型自身抗原特异性抗体,导致对自身细胞、组织、器官的攻击,最终造成临床表现各异的机体损伤。因此,理解IgG抗体的稳态调控机制,尤其是如何避免自身反应性抗体的产生,兼具基础免疫和临床免疫意义。
B细胞通过细胞质膜的B细胞抗原受体(BCRs)识别抗原并启动信号传导。表达IgM-BCR和IgD-BCR的初始型B细胞负责初次抗体反应,而表达IgG-BCR的记忆性B细胞主要在抗原再次暴露时产生高滴度高亲和力的IgG型的记忆性抗体反应。IgM,IgD和IgG等不同亚型的膜结合免疫球蛋白尾部(mIg-Tail)氨基酸序列不同,并影响其下游信号转导功能。例如mIgM-Tail和mIgD-Tail只有三个氨基酸,KVK,负责胞内锚定其穿膜区;而所有mIgG亚型具有进化上保守的28个氨基酸尾部,包含增强信号传导的免疫球蛋白尾部酪氨酸(ITT)基序。小鼠模型和临床队列研究揭示mIgG-Tail在记忆性B细胞的免疫活化和IgG抗体应答中起重要作用,也与自身免疫病、癌症和传染病等多种临床疾病密切有关。上述研究主要是在蛋白氨基酸序列层面对mIgG的研究,且主要针对的是膜结合免疫球蛋白开展(也被称为,膜联型抗体)。
在B细胞中,膜结合(Membrane-bound, mem)和分泌型(Secretory, sec)免疫球蛋白(也被称为膜联型抗体和分泌型抗体,后者即为血液中的可溶性抗体)重链(Immunoglobulin heavy chains, IgH)起源于同样的种系基因座。在抗体分泌B细胞(Antibody-secreting cells, ASCs)中,sec IgH-mRNA转录本占主导地位,且从mem IgH到sec IgH mRNA的转换依赖于mRNA的可变多聚腺苷酸化加工。形成鲜明对比的是,在细胞质膜表达表面BCR的初始型和记忆性B细胞中,mem IgH-mRNA转录本占主导地位。ASCs中增加的IgH转录使得剪切和加尾机制能够利用近端的分泌型特异性poly(A)位点。然而,目前尚不清楚mem IgH向sec IgH转换过程中具体的调控机制。
基于上述科学问题,论文团队联合攻关,发现IgG1重链转录本(IgG1 heavy chain transcripts,Ighg1)mRNA的逐渐加尾和m6A修饰在ASCs中对IgG1抗体的稳态维持至关重要。作为m6A-reader的YTHDF1的缺失会减弱ASC中Ighg1 mRNA的半衰期,从而减少IgG1+ ASCs中的IgG1蛋白丰度,最终导致免疫后IgG在血清中含量的下降。更重要的是,研究团队还发现了一个此前未被研究的剪接中间体(Intermediate Ighg1),揭示其为受到m6A修饰的主要的Ighg1亚型。m6A修饰和YTHDF1的核定位均是维持ASCs中高Ighg1转录本丰度的关键因素,Ighg1与YTHDF1共同形成类似核糖核蛋白(Ribonucleoprotein,RNP)颗粒的结构。该结构的形成和维持对IgG1抗体稳态有至关重要的作用。上述数据揭示浆细胞妙用乾坤,采取以方寸赢朝夕的哲学,来稳妥处理潜在的高度同质化的Ighg1 mRNA所造成的细胞内质网应激(ER stress)的严峻问题(图1)。
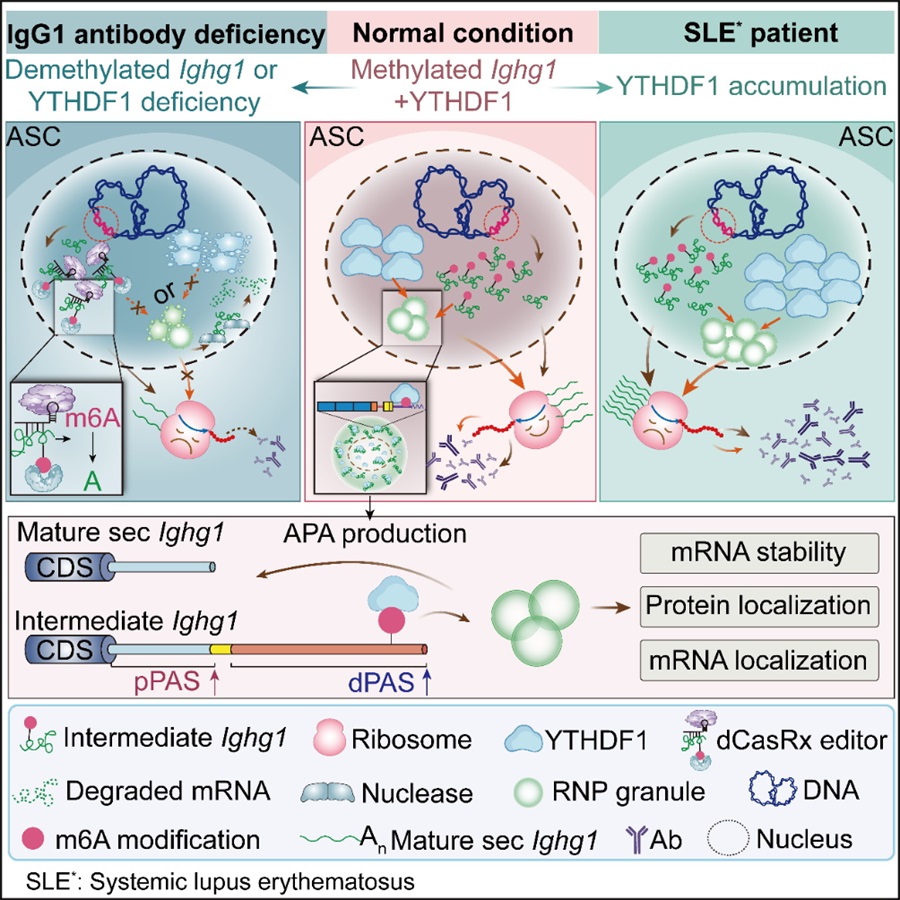
图1 ASCs通过整合Ighg1 mRNA加工修饰维持IgG抗体转录本稳态
为了继续探索上述分子细胞免疫学基础机制的临床价值,研究团队还将注意力转向了自身免疫疾病,特别其中最顽固最难缠最有代表性的SLE疾病。发现YTHDF1在SLE患者的ASCs中表现出过表达特征(图1)。通过单细胞测序分析,揭示一个具有高YTHDF1表达的ASCs亚群(ASC-C4)在SLE患者中显著增加,而在接受免疫抑制治疗后,这一亚群减少并回归到健康志愿者的相关水平。这一发现暗示YTHDF1可能在SLE等自身免疫疾病的发病过程中发挥重要作用,为了进一步的验证YTHDF1在自身免疫疾病中的潜在治疗价值,论文团队使用小鼠SLE模型进行了实验,发现阻断YTHDF1与m6A的相互作用能够有效缓解SLE症状,减少自身抗体的产生。这一结果表明YTHDF1-m6A通路可能成为自体免疫疾病治疗的新靶点。
综上所述,此项研究不仅揭示了YTHDF1在自身免疫反应的潜在病理作用,还为理解SLE的复杂免疫机制提供了新的科学依据。YTHDF1过表达可能是SLE患者体内对持续免疫刺激的过度应答,这种情况可能导致其负责分泌抗体的ASCs持续产生自身抗体,从而加剧免疫系统对自身组织的攻击。因此,YTHDF1的调控对于控制SLE的病情进展具有重要意义。通过抑制YTHDF1与m6A的相互作用,能够显著减少自身抗体的产生,表明这一靶点在控制异常免疫反应方面的潜力。
清华大学生命学院2018级博士生王昱为论文第一作者,博士后张少存为共同第一作者。清华大学生命学院、CLS生命中心、免疫学研究所、膜生物学全国重点实验室、教育部蛋白质科学重点实验室的刘万里教授是论文的首要通讯作者(Lead Corresponding Author),清华大学医学院徐萌研究员和生命学院博士后张少存是本文的共同通讯作者(Co-corresponding Author)。本研究的完成需要大力整合基础免疫学、临床免疫学、RNA生物学、分子成像学、分子细胞生物学、计算生物学和风湿病学等交叉学科的各自优势资源和思维。其中,清华大学生命学院的王昱和张少存为共同第一作者,王昱负责分子细胞以及生物信息学,张少存博士负责免疫学工作及文章整理工作;研究过程得到来自清华大学医学院祁海教授,合肥综合性国家科学中心大健康研究院童佩研究员,中科院生物物理所侯百东研究员,武汉大学周宇教授,西湖大学谢琦研究员,北京大学邹鹏研究员和北京大学人民医院风湿免疫科栗占国教授和孙晓麟研究员的大力支持。论文研究也得到了光飞纳科技有限公司齐冬和尹强工程师、江苏瑞明生物科技有限公司/单细胞检测多模式检测和武汉奥科生物技术有限公司的大力支持。项目联合研究团队得到国家自然科学基金委杰青项目、重大研究计划、专项项目、重点项目,国家科技部重点研发计划,北京自然科学基金重点项目、CLS生命中心、CLS博士后基金、清华大学免疫学研究所和深圳SMART基金的大力资助。
原文链接:https://linkinghub.elsevier.com/retrieve/pii/S1074-7613(24)00484-9
两千五百年前,古希腊的修昔底德(Thucydides)曾经这样描述公元前430年雅典城的一场瘟疫:“染病而垂死的病人,只能被那些已经染病但侥幸康复的人照顾。这些康复者虽然每天照料染病者,但对此并不担心,因为他们了解瘟疫的特征和进程。的确,他们很清楚,在这次瘟疫中,幸存者将不会被瘟疫第二次感染,至少不会因此丧命”。
两千五百年后,现代免疫学研究才逐渐的解析了其中的基本生物医学原理:病原体感染机体后,初始型B细胞(Mature naïve B cell)产生抗体抵御病原体;康复者获得记忆性B细胞,此类B细胞承载IgG抗体记忆,遇到相同病原体时快速免疫活化并产生IgG型的病原体特异性抗体,从而有效抵御病原体的致命攻击。凭借这一生物医学基本原理,人类已经清除天花病毒,接近根除脊髓灰质炎病毒,并有效控制了如麻疹、流脑、白喉等恶性传染病。尽管取得了巨大进展,人类对IgG抗体的稳态维持机制仍然缺乏深入了解。这一科学问题在临床免疫学研究的自身免疫紊乱等方面疾病尤为重要,例如系统性红斑狼疮(Systemic lupus erythematosus, SLE),SLE患者通常表现为异常的免疫应答,其体内的自身反应性B细胞打破免疫耐受,分化为浆细胞而产生过多的IgG型自身抗原特异性抗体,导致对自身细胞、组织、器官的攻击,最终造成临床表现各异的机体损伤。因此,理解IgG抗体的稳态调控机制,尤其是如何避免自身反应性抗体的产生,兼具基础免疫和临床免疫意义。
B细胞通过细胞质膜的B细胞抗原受体(BCRs)识别抗原并启动信号传导。表达IgM-BCR和IgD-BCR的初始型B细胞负责初次抗体反应,而表达IgG-BCR的记忆性B细胞主要在抗原再次暴露时产生高滴度高亲和力的IgG型的记忆性抗体反应。IgM,IgD和IgG等不同亚型的膜结合免疫球蛋白尾部(mIg-Tail)氨基酸序列不同,并影响其下游信号转导功能。例如mIgM-Tail和mIgD-Tail只有三个氨基酸,KVK,负责胞内锚定其穿膜区;而所有mIgG亚型具有进化上保守的28个氨基酸尾部,包含增强信号传导的免疫球蛋白尾部酪氨酸(ITT)基序。小鼠模型和临床队列研究揭示mIgG-Tail在记忆性B细胞的免疫活化和IgG抗体应答中起重要作用,也与自身免疫病、癌症和传染病等多种临床疾病密切有关。上述研究主要是在蛋白氨基酸序列层面对mIgG的研究,且主要针对的是膜结合免疫球蛋白开展(也被称为,膜联型抗体)。
在B细胞中,膜结合(Membrane-bound, mem)和分泌型(Secretory, sec)免疫球蛋白(也被称为膜联型抗体和分泌型抗体,后者即为血液中的可溶性抗体)重链(Immunoglobulin heavy chains, IgH)起源于同样的种系基因座。在抗体分泌B细胞(Antibody-secreting cells, ASCs)中,sec IgH-mRNA转录本占主导地位,且从mem IgH到sec IgH mRNA的转换依赖于mRNA的可变多聚腺苷酸化加工。形成鲜明对比的是,在细胞质膜表达表面BCR的初始型和记忆性B细胞中,mem IgH-mRNA转录本占主导地位。ASCs中增加的IgH转录使得剪切和加尾机制能够利用近端的分泌型特异性poly(A)位点。然而,目前尚不清楚mem IgH向sec IgH转换过程中具体的调控机制。
基于上述科学问题,论文团队联合攻关,发现IgG1重链转录本(IgG1 heavy chain transcripts,Ighg1)mRNA的逐渐加尾和m6A修饰在ASCs中对IgG1抗体的稳态维持至关重要。作为m6A-reader的YTHDF1的缺失会减弱ASC中Ighg1 mRNA的半衰期,从而减少IgG1+ ASCs中的IgG1蛋白丰度,最终导致免疫后IgG在血清中含量的下降。更重要的是,研究团队还发现了一个此前未被研究的剪接中间体(Intermediate Ighg1),揭示其为受到m6A修饰的主要的Ighg1亚型。m6A修饰和YTHDF1的核定位均是维持ASCs中高Ighg1转录本丰度的关键因素,Ighg1与YTHDF1共同形成类似核糖核蛋白(Ribonucleoprotein,RNP)颗粒的结构。该结构的形成和维持对IgG1抗体稳态有至关重要的作用。上述数据揭示浆细胞妙用乾坤,采取以方寸赢朝夕的哲学,来稳妥处理潜在的高度同质化的Ighg1 mRNA所造成的细胞内质网应激(ER stress)的严峻问题(图1)。

图1 ASCs通过整合Ighg1 mRNA加工修饰维持IgG抗体转录本稳态
为了继续探索上述分子细胞免疫学基础机制的临床价值,研究团队还将注意力转向了自身免疫疾病,特别其中最顽固最难缠最有代表性的SLE疾病。发现YTHDF1在SLE患者的ASCs中表现出过表达特征(图1)。通过单细胞测序分析,揭示一个具有高YTHDF1表达的ASCs亚群(ASC-C4)在SLE患者中显著增加,而在接受免疫抑制治疗后,这一亚群减少并回归到健康志愿者的相关水平。这一发现暗示YTHDF1可能在SLE等自身免疫疾病的发病过程中发挥重要作用,为了进一步的验证YTHDF1在自身免疫疾病中的潜在治疗价值,论文团队使用小鼠SLE模型进行了实验,发现阻断YTHDF1与m6A的相互作用能够有效缓解SLE症状,减少自身抗体的产生。这一结果表明YTHDF1-m6A通路可能成为自体免疫疾病治疗的新靶点。
综上所述,此项研究不仅揭示了YTHDF1在自身免疫反应的潜在病理作用,还为理解SLE的复杂免疫机制提供了新的科学依据。YTHDF1过表达可能是SLE患者体内对持续免疫刺激的过度应答,这种情况可能导致其负责分泌抗体的ASCs持续产生自身抗体,从而加剧免疫系统对自身组织的攻击。因此,YTHDF1的调控对于控制SLE的病情进展具有重要意义。通过抑制YTHDF1与m6A的相互作用,能够显著减少自身抗体的产生,表明这一靶点在控制异常免疫反应方面的潜力。
清华大学生命学院2018级博士生王昱为论文第一作者,博士后张少存为共同第一作者。清华大学生命学院、CLS生命中心、免疫学研究所、膜生物学全国重点实验室、教育部蛋白质科学重点实验室的刘万里教授是论文的首要通讯作者(Lead Corresponding Author),清华大学医学院徐萌研究员和生命学院博士后张少存是本文的共同通讯作者(Co-corresponding Author)。本研究的完成需要大力整合基础免疫学、临床免疫学、RNA生物学、分子成像学、分子细胞生物学、计算生物学和风湿病学等交叉学科的各自优势资源和思维。其中,清华大学生命学院的王昱和张少存为共同第一作者,王昱负责分子细胞以及生物信息学,张少存博士负责免疫学工作及文章整理工作;研究过程得到来自清华大学医学院祁海教授,合肥综合性国家科学中心大健康研究院童佩研究员,中科院生物物理所侯百东研究员,武汉大学周宇教授,西湖大学谢琦研究员,北京大学邹鹏研究员和北京大学人民医院风湿免疫科栗占国教授和孙晓麟研究员的大力支持。论文研究也得到了光飞纳科技有限公司齐冬和尹强工程师、江苏瑞明生物科技有限公司/单细胞检测多模式检测和武汉奥科生物技术有限公司的大力支持。项目联合研究团队得到国家自然科学基金委杰青项目、重大研究计划、专项项目、重点项目,国家科技部重点研发计划,北京自然科学基金重点项目、CLS生命中心、CLS博士后基金、清华大学免疫学研究所和深圳SMART基金的大力资助。
原文链接:https://linkinghub.elsevier.com/retrieve/pii/S1074-7613(24)00484-9
