学术动态
黄河/刘明耀团队合作发文报道非病毒定点整合CAR-T 细胞治疗复发/难治 B 细胞淋巴瘤取得重大突破
作者:黄河 来源自:中国免疫学会 点击数:10697 发布时间:2022-10-11
浙江大学医学院附属第一医院黄河教授/胡永仙主任医师团队、邦耀生物和华东师范大学刘明耀教授/张楫钦副研究员团队合作报道了一种新型CAR-T细胞制备策略:应用CRISPR/Cas9基因编辑技术对T淋巴细胞中PD1位点精确敲除、定点插入针对肿瘤细胞的靶向CD19 CAR分子,构建完成全新的非病毒定点整合CAR-T细胞(PD1-19bbz),并在人体内完成Ⅰ期临床研究。研究成果以“非病毒定点整合CAR-T 细胞治疗复发/难治性 B 细胞非霍奇金淋巴瘤具有高安全性及有效性,Non-viral, specifically targeted CAR-T cells achieve high safety and efficacy in B-NHL”为题,于2022年8月31日发表在《自然》(Nature)。
CRISPR/Cas9介导的非病毒定点整合CAR-T细胞技术可以有效解决使用病毒载体带来的几大难题,展现出了巨大的优势。定点整合可以让每个CAR序列都精确地插入到基因组的特定位点,能避免随机插入导致的致瘤风险,最大程度保证了CAR-T产品的安全性和有效性。只需一步制备,即可同时实现CAR的持续性表达和T细胞内源基因的调控,大大缩短了整个CAR-T产品的制备时间,得以让更多患者受益。另外,使用非病毒生产工艺还可以极大减少因使用病毒载体带来的高昂成本。
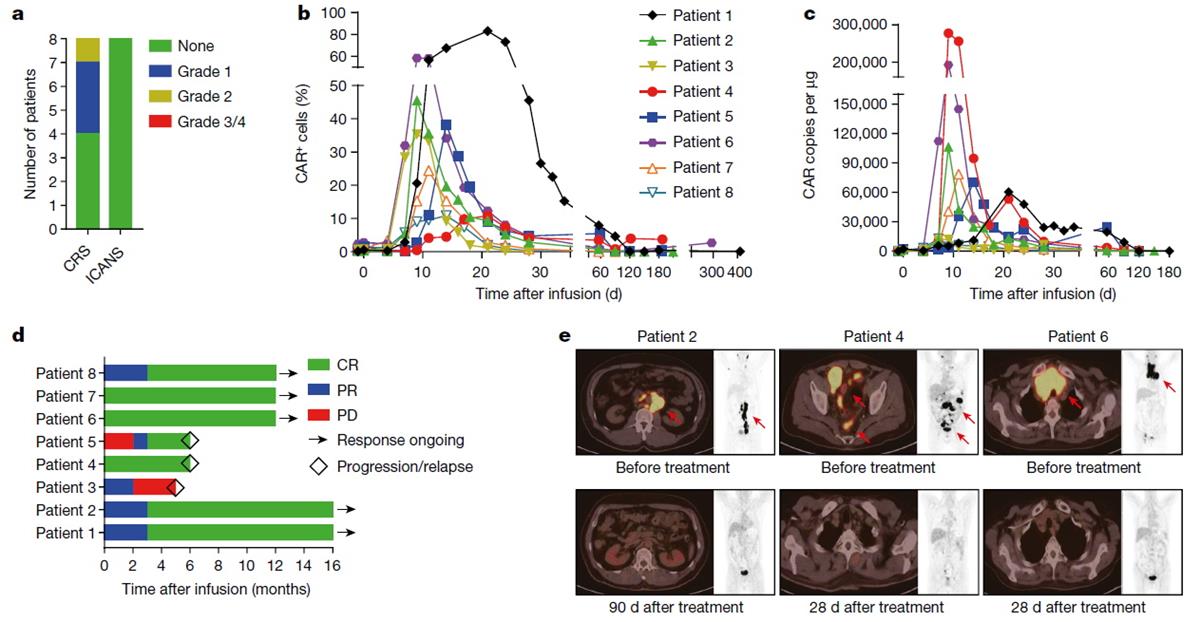
本研究全球首次利用CRISPR/Cas9基因编辑技术在PD1位点实现定点整合的CAR-T细胞产品,也是世界首例非病毒PD1定点整合CAR-T细胞治疗淋巴瘤的临床研究。研究结果表明,使用同源臂长度为800bp的线性双链DNA作为模板可以通过同源介导修复(HDR)机制获得数量最多的CAR整合细胞;PD1-19bbz CAR-T细胞无论在PD-L1高表达还是低表达的肿瘤细胞中,都体现出更强大、更持久的杀伤效果,小鼠生存率得到显著提高;进一步开展临床研究表明:在接受治疗患者中未观察到CAR-T治疗相关的神经毒性和2级以上的细胞因子释放综合征,证明PD1-19bbz CAR-T细胞具有出色的临床安全性。用PCR技术和流式细胞术方法检测发现PD1-19bbz CAR-T细胞在患者体内可获得快速扩增和长时间的维持。在难治复发淋巴瘤患者中,客观缓解率高达100%,完全缓解率达到87.5%。进一步单细胞测序研究结果表明,PD1-19bbz CAR-T细胞产品中存在高比例的记忆性T细胞,体内PD1-19bbz CAR-T细胞具有更强的杀伤肿瘤作用,长期存续的CAR-T细胞具有记忆性细胞的特征。全面阐明了非病毒PD1定点整合CAR-T细胞优越的临床疗效背后的作用机制。
该成果获得了加利福尼亚大学Justin Eyquem教授和Nature资深编辑Victoria Aranda的高度评价:“全面系统的临床前研究,成功开发了非病毒定点整合CAR-T疗法,并报道了首个PD1下调定点整合型CAR-T细胞的临床试验结果。研究人员在临床治疗中观察到了高比例的肿瘤完全缓解率,且未发现严重的毒副作用,这一令人鼓舞的结果显示出这种CAR-T疗法具有出色的临床安全性和有效性。研究人员同时也证明了非病毒定点整合T细胞治疗在临床应用的可行性。这一技术创新为未来更多基因靶向修饰CAR-T疗法的发展奠定了坚实的基础,对领域发展具有重要的推动作用。”
这项工作的成功意味着全新CAR-T细胞技术平台的建立,也是迄今为止全球CAR-T细胞治疗难治复发淋巴瘤中高缓解率和低毒副反应的最好临床结果。标志着中国学者在CAR-T细胞研发及临床转化应用领域处于国际领先地位。
本研究工作得到国家自然科学基金和浙江省重点研发计划等项目的资助。浙江大学医学院附属第一医院黄河教授为论文第一通讯作者,邦耀生物刘明耀教授、杜冰教授和李大力教授为论文共同通讯作者,张楫钦(华东师范大学)、胡永仙(浙江大学医学院附属第一医院)和杨佳璇(华东师范大学)为论文的共同第一作者。
论文链接:https://www.nature.com/articles/s41586-022-05140-y
CRISPR/Cas9介导的非病毒定点整合CAR-T细胞技术可以有效解决使用病毒载体带来的几大难题,展现出了巨大的优势。定点整合可以让每个CAR序列都精确地插入到基因组的特定位点,能避免随机插入导致的致瘤风险,最大程度保证了CAR-T产品的安全性和有效性。只需一步制备,即可同时实现CAR的持续性表达和T细胞内源基因的调控,大大缩短了整个CAR-T产品的制备时间,得以让更多患者受益。另外,使用非病毒生产工艺还可以极大减少因使用病毒载体带来的高昂成本。

本研究全球首次利用CRISPR/Cas9基因编辑技术在PD1位点实现定点整合的CAR-T细胞产品,也是世界首例非病毒PD1定点整合CAR-T细胞治疗淋巴瘤的临床研究。研究结果表明,使用同源臂长度为800bp的线性双链DNA作为模板可以通过同源介导修复(HDR)机制获得数量最多的CAR整合细胞;PD1-19bbz CAR-T细胞无论在PD-L1高表达还是低表达的肿瘤细胞中,都体现出更强大、更持久的杀伤效果,小鼠生存率得到显著提高;进一步开展临床研究表明:在接受治疗患者中未观察到CAR-T治疗相关的神经毒性和2级以上的细胞因子释放综合征,证明PD1-19bbz CAR-T细胞具有出色的临床安全性。用PCR技术和流式细胞术方法检测发现PD1-19bbz CAR-T细胞在患者体内可获得快速扩增和长时间的维持。在难治复发淋巴瘤患者中,客观缓解率高达100%,完全缓解率达到87.5%。进一步单细胞测序研究结果表明,PD1-19bbz CAR-T细胞产品中存在高比例的记忆性T细胞,体内PD1-19bbz CAR-T细胞具有更强的杀伤肿瘤作用,长期存续的CAR-T细胞具有记忆性细胞的特征。全面阐明了非病毒PD1定点整合CAR-T细胞优越的临床疗效背后的作用机制。
该成果获得了加利福尼亚大学Justin Eyquem教授和Nature资深编辑Victoria Aranda的高度评价:“全面系统的临床前研究,成功开发了非病毒定点整合CAR-T疗法,并报道了首个PD1下调定点整合型CAR-T细胞的临床试验结果。研究人员在临床治疗中观察到了高比例的肿瘤完全缓解率,且未发现严重的毒副作用,这一令人鼓舞的结果显示出这种CAR-T疗法具有出色的临床安全性和有效性。研究人员同时也证明了非病毒定点整合T细胞治疗在临床应用的可行性。这一技术创新为未来更多基因靶向修饰CAR-T疗法的发展奠定了坚实的基础,对领域发展具有重要的推动作用。”
这项工作的成功意味着全新CAR-T细胞技术平台的建立,也是迄今为止全球CAR-T细胞治疗难治复发淋巴瘤中高缓解率和低毒副反应的最好临床结果。标志着中国学者在CAR-T细胞研发及临床转化应用领域处于国际领先地位。
本研究工作得到国家自然科学基金和浙江省重点研发计划等项目的资助。浙江大学医学院附属第一医院黄河教授为论文第一通讯作者,邦耀生物刘明耀教授、杜冰教授和李大力教授为论文共同通讯作者,张楫钦(华东师范大学)、胡永仙(浙江大学医学院附属第一医院)和杨佳璇(华东师范大学)为论文的共同第一作者。
论文链接:https://www.nature.com/articles/s41586-022-05140-y
