学术动态
徐和平课题组发现氧化磷酸化通路具有促进GC B细胞亲和力正向筛选的重要作用
作者:徐和平 来源自:中国免疫学会 点击数:43005 发布时间:2021-05-25
2021年5月24日,西湖大学徐和平课题组在《Nature Immunology》杂志在线发表题为“Coupled analysis of transcriptome and BCR mutations reveals role of OXPHOS in affinity maturation”的研究成果。基于整合分析抗体突变模式与转录组信息并结合遗传学实验手段,揭示了OXPHOS通路在生发中心(Germinal Center, GC)B细胞亲和力正向筛选中的关键作用。
高亲和力的中和型抗体是机体长效抵抗病原微生物感染的重要武器,是绝大多数疫苗发挥作用的基础。抗体亲和力成熟所必须的B细胞受体(B cell receptors, BCRs)可变区高频突变与正向筛选发生在脾脏与淋巴结内部一个称之为GC的组织结构区域。GC分为两个功能不同的区域——暗区和明区。B细胞在不同区域间反复迁移,并通过达尔文式的演化过程实现对高亲和力BCR突变的正向筛选,最终筛选出产生能够高亲和力抗体的浆细胞。由于领域内一直缺乏有效的分子标记从一个多克隆免疫反应中区分和富集出获得高亲和力突变的GC B细胞,当前具体哪些胞内分子通路在支持高亲和力GC B细胞的正向筛选这一重要问题还未被系统性的研究。
基于经典的NP-KLH免疫小鼠模型,徐和平课题组创新性地在单细胞水平上将抗体突变模式与转录组表达水平进行关联分析来突破这一研究难题(图1)。NP-KLH是一种T细胞依赖性抗原,已知其在小鼠模型内诱导出的生发中心反应达到顶峰时,与半抗原NP特异性结合的GC B细胞主要表达抗体重链可变区基因片段VH186.2;此外,该基因编码的氨基酸序列的第33位色氨酸突变成亮氨酸后,BCR与NP的亲和力提升至原来的10倍,而其他的随机突变并不显著性地改变亲和力。以上两个重要的免疫应答特性使得研究者们可根据BCR序列的突变情况来区分NP结合亲和力的高低。在此基础上,利用5’端单细胞转录组分析技术可同时获得每个B细胞的BCR序列突变模式和转录组信息,从而可对与亲和力成熟相关联的分子机制进行全面挖掘与分析。
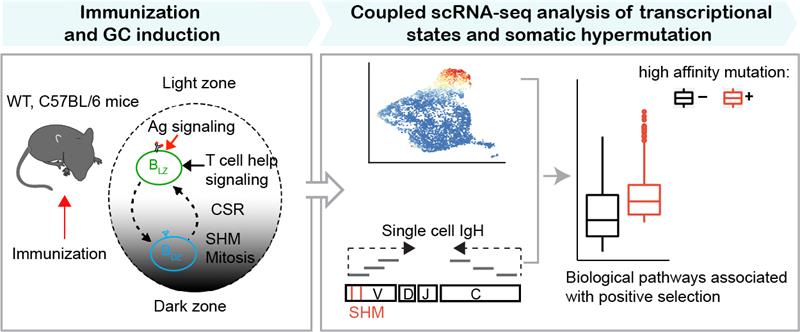
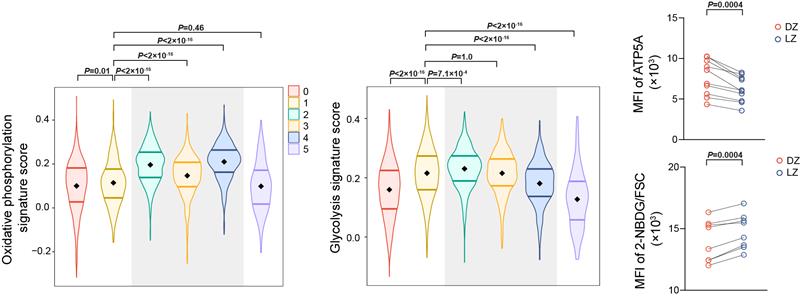
基于转录组数据和已知的基因表达特征,作者们首先确认了不同类群GC B细胞所处的空间区域和细胞周期等状态。为了更加全面探索细胞基因模块表达的变化,作者们引入了机器学习中的主题模型算法。相较传统的比较不同类群细胞间差异表达基因的方法,主题模型算法除了能找到分群特异性基因特征外,还能够发现跨分群的基因模块,实现对细胞状态更精细化的描绘。比如过去有研究认为生发中心明区氧含量较低,从而认为GC B细胞只能够进行糖酵解。而本工作中的主题模型分析揭示和比较了不同区域GC B细胞的代谢特征,发现明区细胞表达更高水平的糖酵解通路相关基因,相反,暗区细胞则表达更多的OXPHOS和脂肪酸氧化通路基因,表明不同区域GC B细胞具有不同的代谢活动(图2);这在一定程度上说明之前关于GC B细胞只进行糖酵解的结论是不正确的。在本研究准备投稿过程中,有新发表的工作通过体外检测原代GC B细胞代谢活动也说明GC B细胞主要进行OXPHOS,而不是糖酵解。
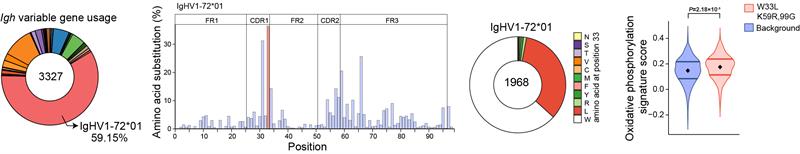
更重要的是通过结合BCR突变模式信息,作者们发现有高亲和力突变 (获得W33L突变的 VH186.2 基因)的NP特异性GC B细胞相较低亲和力群体具有更高的OXPHOS通路的基因表达,暗示了该通路可能在亲和力成熟过程中发挥重要作用(图3)。
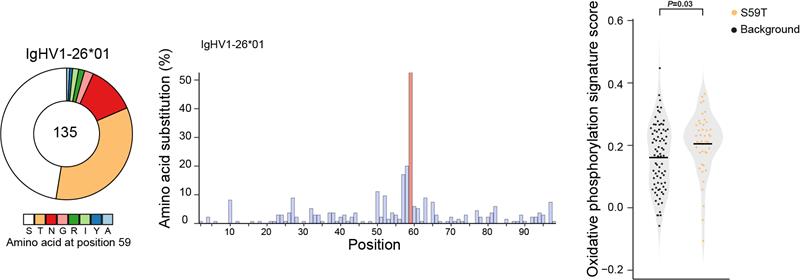
此外,在OVA蛋白抗原诱导出的更复杂的多克隆免疫应答模型中,作者们不仅进一步确认了OXPHOS与亲和力正向筛选之间具有正相关性,也说明了本工作开发出的研究方法可用于解析更为复杂的B细胞免疫应答特征(图4)。
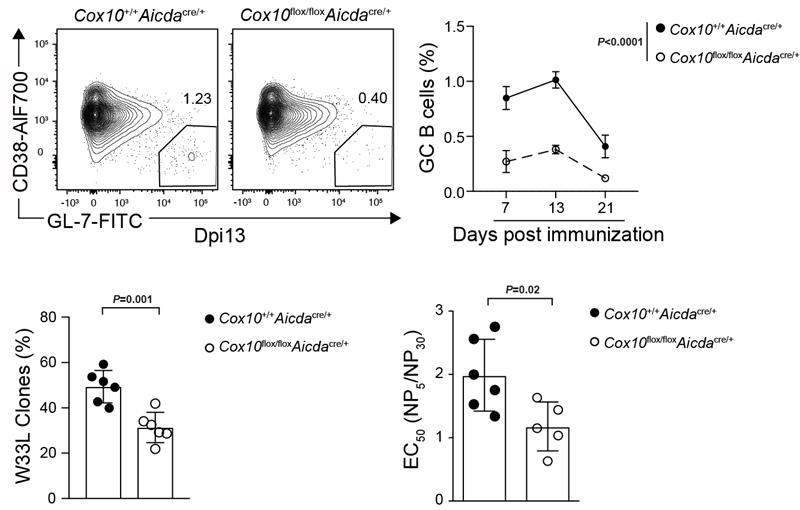
通过与匹兹堡大学Harinder Singh教授的合作,作者们通过遗传学手段验证体内OXPHOS通路在亲和力正向筛选过程中的作用。Cox10基因编码血红素IX法尼基转移酶,是线粒体电子传递链上细胞色素c氧化酶复合物的重要组成部分,其缺失后会导致OXPHOS活动受损。相较对照组小鼠,GC B 细胞中Cox10缺陷小鼠的GC B细胞的比例,增殖以及抗体的亲和力都显著性地下降,证明GC B细胞依赖OXPHOS来实现亲和力正向筛选(图5)。
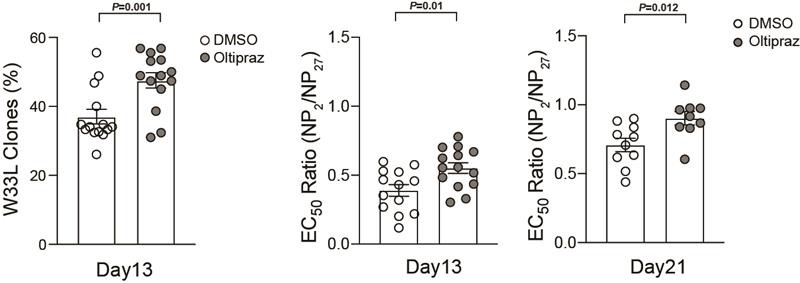
最后,通过尝试多种被报道能够促进OXPHOS活性的小分子,作者们发现一种名为oltipraz小分子能够在体内促进GC B细胞的正向筛选和抗体亲和力成熟,这是目前第一个被报道具有类似功能的化学小分子(图6)。
本研究成果不仅证明了OXPHOS通过促进高亲和力GC B细胞的快速分裂来促进正向筛选和亲和力成熟,还为通过小分子干预抗体亲和力成熟过程和疫苗设计提供了新的思路和靶点。此外,利用项目开发的分析方法与流程,本研究工作还成功分析出复杂抗原的BCR应答突变模式与分子通路表达的相关性,证明了该方法能够广泛应用于解析诸如自身免疫、移植排异免疫等复杂疾病中BCRs多样性与分子应答特征。
西湖大学徐和平研究员和匹兹堡大学Harinder Singh教授为论文共同通讯作者,西湖大学博士研究生陈钿雨、王琰和匹兹堡大学博士后Godhev K Manakkat Vijay为本文共同第一作者,此外科研助理富舒洁为项目的推进做出了重要的贡献。本项目受到国家自然基金委、科技部重点研发计划以及西湖教育基金会的资助;项目实施过程中得到了西湖大学实验动物中心、流式平台、基因组学平台以及超算平台的大力支持。
原文链接:https://www.nature.com/articles/s41590-021-00936-y
附徐和平课题组简介与招聘信息:
西湖大学系统免疫学实验室致力于探究调节体液免疫应答与黏膜炎症反应的关键分子机制与网络。在有机整合利用遗传学动物模型、临床样本以及前沿生物信息学的基础上,着重研究免疫与神经系统等组织特异性微环境在炎症反应与抗体应答中的互作机制。近年来在Nature(2篇)、Nature Immunology(2篇)、Immunity(1篇)等主流杂志上发表多篇学术论文。在国家海外高层次人才项目、国家自然基金委联合基金重点项目以及科技部重点研发计划等项目的支持下,实验室各项课题进展顺利,当前急需青年才俊加入团队,共同成长和发展!实验室有多个博士后、博士生与科研助理岗位,欢迎联系 (xuheping@westlake.edu.cn)!
高亲和力的中和型抗体是机体长效抵抗病原微生物感染的重要武器,是绝大多数疫苗发挥作用的基础。抗体亲和力成熟所必须的B细胞受体(B cell receptors, BCRs)可变区高频突变与正向筛选发生在脾脏与淋巴结内部一个称之为GC的组织结构区域。GC分为两个功能不同的区域——暗区和明区。B细胞在不同区域间反复迁移,并通过达尔文式的演化过程实现对高亲和力BCR突变的正向筛选,最终筛选出产生能够高亲和力抗体的浆细胞。由于领域内一直缺乏有效的分子标记从一个多克隆免疫反应中区分和富集出获得高亲和力突变的GC B细胞,当前具体哪些胞内分子通路在支持高亲和力GC B细胞的正向筛选这一重要问题还未被系统性的研究。
基于经典的NP-KLH免疫小鼠模型,徐和平课题组创新性地在单细胞水平上将抗体突变模式与转录组表达水平进行关联分析来突破这一研究难题(图1)。NP-KLH是一种T细胞依赖性抗原,已知其在小鼠模型内诱导出的生发中心反应达到顶峰时,与半抗原NP特异性结合的GC B细胞主要表达抗体重链可变区基因片段VH186.2;此外,该基因编码的氨基酸序列的第33位色氨酸突变成亮氨酸后,BCR与NP的亲和力提升至原来的10倍,而其他的随机突变并不显著性地改变亲和力。以上两个重要的免疫应答特性使得研究者们可根据BCR序列的突变情况来区分NP结合亲和力的高低。在此基础上,利用5’端单细胞转录组分析技术可同时获得每个B细胞的BCR序列突变模式和转录组信息,从而可对与亲和力成熟相关联的分子机制进行全面挖掘与分析。

图1:整合BCR突变信息和转录组数据揭示抗体亲和力成熟的关键分子机制
基于转录组数据和已知的基因表达特征,作者们首先确认了不同类群GC B细胞所处的空间区域和细胞周期等状态。为了更加全面探索细胞基因模块表达的变化,作者们引入了机器学习中的主题模型算法。相较传统的比较不同类群细胞间差异表达基因的方法,主题模型算法除了能找到分群特异性基因特征外,还能够发现跨分群的基因模块,实现对细胞状态更精细化的描绘。比如过去有研究认为生发中心明区氧含量较低,从而认为GC B细胞只能够进行糖酵解。而本工作中的主题模型分析揭示和比较了不同区域GC B细胞的代谢特征,发现明区细胞表达更高水平的糖酵解通路相关基因,相反,暗区细胞则表达更多的OXPHOS和脂肪酸氧化通路基因,表明不同区域GC B细胞具有不同的代谢活动(图2);这在一定程度上说明之前关于GC B细胞只进行糖酵解的结论是不正确的。在本研究准备投稿过程中,有新发表的工作通过体外检测原代GC B细胞代谢活动也说明GC B细胞主要进行OXPHOS,而不是糖酵解。

图2:不同区域GC B细胞表现出不同的代谢特征 (灰色背景的为暗区 GC 细胞)
更重要的是通过结合BCR突变模式信息,作者们发现有高亲和力突变 (获得W33L突变的 VH186.2 基因)的NP特异性GC B细胞相较低亲和力群体具有更高的OXPHOS通路的基因表达,暗示了该通路可能在亲和力成熟过程中发挥重要作用(图3)。

图3:NP特异性GC B细胞免疫应答中OXPHOS与VH186.2亲和力呈正相关性
此外,在OVA蛋白抗原诱导出的更复杂的多克隆免疫应答模型中,作者们不仅进一步确认了OXPHOS与亲和力正向筛选之间具有正相关性,也说明了本工作开发出的研究方法可用于解析更为复杂的B细胞免疫应答特征(图4)。

图4:OVA特异性GC B细胞免疫应答中OXPHOS与VH186.2亲和力呈正相关性
通过与匹兹堡大学Harinder Singh教授的合作,作者们通过遗传学手段验证体内OXPHOS通路在亲和力正向筛选过程中的作用。Cox10基因编码血红素IX法尼基转移酶,是线粒体电子传递链上细胞色素c氧化酶复合物的重要组成部分,其缺失后会导致OXPHOS活动受损。相较对照组小鼠,GC B 细胞中Cox10缺陷小鼠的GC B细胞的比例,增殖以及抗体的亲和力都显著性地下降,证明GC B细胞依赖OXPHOS来实现亲和力正向筛选(图5)。

图5:Cox10基因缺失抑制GC反应与抗体亲和力成熟
最后,通过尝试多种被报道能够促进OXPHOS活性的小分子,作者们发现一种名为oltipraz小分子能够在体内促进GC B细胞的正向筛选和抗体亲和力成熟,这是目前第一个被报道具有类似功能的化学小分子(图6)。

图6:小分子oltipraz具有加速抗体亲和力成熟的作用
本研究成果不仅证明了OXPHOS通过促进高亲和力GC B细胞的快速分裂来促进正向筛选和亲和力成熟,还为通过小分子干预抗体亲和力成熟过程和疫苗设计提供了新的思路和靶点。此外,利用项目开发的分析方法与流程,本研究工作还成功分析出复杂抗原的BCR应答突变模式与分子通路表达的相关性,证明了该方法能够广泛应用于解析诸如自身免疫、移植排异免疫等复杂疾病中BCRs多样性与分子应答特征。
西湖大学徐和平研究员和匹兹堡大学Harinder Singh教授为论文共同通讯作者,西湖大学博士研究生陈钿雨、王琰和匹兹堡大学博士后Godhev K Manakkat Vijay为本文共同第一作者,此外科研助理富舒洁为项目的推进做出了重要的贡献。本项目受到国家自然基金委、科技部重点研发计划以及西湖教育基金会的资助;项目实施过程中得到了西湖大学实验动物中心、流式平台、基因组学平台以及超算平台的大力支持。
原文链接:https://www.nature.com/articles/s41590-021-00936-y
附徐和平课题组简介与招聘信息:
西湖大学系统免疫学实验室致力于探究调节体液免疫应答与黏膜炎症反应的关键分子机制与网络。在有机整合利用遗传学动物模型、临床样本以及前沿生物信息学的基础上,着重研究免疫与神经系统等组织特异性微环境在炎症反应与抗体应答中的互作机制。近年来在Nature(2篇)、Nature Immunology(2篇)、Immunity(1篇)等主流杂志上发表多篇学术论文。在国家海外高层次人才项目、国家自然基金委联合基金重点项目以及科技部重点研发计划等项目的支持下,实验室各项课题进展顺利,当前急需青年才俊加入团队,共同成长和发展!实验室有多个博士后、博士生与科研助理岗位,欢迎联系 (xuheping@westlake.edu.cn)!
