学术动态
曹雪涛课题组《Immunity》报道新型长链非编码RNA-GM调控抗病毒天然免疫新机制
作者:王羽佳 来源自:中国免疫学会 点击数:58081 发布时间:2020-12-31
天然免疫反应为机体抵御病毒、细菌等外界病原体的入侵提供了第一道防线。当病毒的核酸及蛋白产物等病原相关分子模式被细胞表面的模式识别受体,通过多种接头蛋白激活共同的下游激酶TBK1,进而催化干扰素调控因子IRF3的磷酸化,启动下游I型干扰素的表达。干扰素的产生对于机体维持稳态至关重要,干扰素产生不足则机体无法有效抵抗病毒感染,而过多的干扰素则会造成机体组织损伤,甚至自身免疫病的发生发展。因此如何精密调节天然免疫的活化和抑制是免疫学的重要研究领域。
以往的研究表明天然免疫信号转导过程中关键蛋白的表达以及活性受到多种翻译后修饰(PTMs)的调控。长链非编码 RNA(lncRNA)是近些年新兴的研究热点,其作用机制多样,为解释病毒与机体天然免疫的博弈提供了新的可能性。lncRNA 与蛋白质分子发生相互作用并调控蛋白质的PTM,是目前细胞分化发育、功能调控及其疾病发生发展机制研究的热点。然而在抗病毒天然免疫应答调控领域,是否存在lncRNA通过影响天然免疫关键信号蛋白分子的PTM来调控抗病毒天然免疫呢?病毒感染状态下lncRNA拷贝数的变化是否会影响它与天然免疫蛋白分子的相互作用呢?病毒能否利用宿主lncRNA或蛋白PTM以利于自身免疫逃逸呢?这些问题仍未得到解答。
2020年12月15日,曹雪涛院士团队在Immunity杂志在线发表“Decreased Expression of the Host Long-Noncoding RNA-GM Facilitates Viral Escape by Inhibiting the Kinase activity TBK1 via S-glutathionylation”的文章,第一作者为浙江大学博士生王羽佳,对这些科学问题进行了深入的探讨。在这个工作中,研究人员鉴定出了一种与蛋白质 S-谷胱甘肽化修饰作用相关的lncRNA,将它命名为lncRNA-GM(Glutathionylation modification)。研究人员发现多种病毒皆能够引起lncRNA-GM的表达下调。进一步通过体外敲低lncRNA-GM以及构建lncRNA-GM缺陷小鼠,研究人员发现lncRNA-GM是宿主激活TBK1和干扰素表达所必须的,而病毒能够通过抑制其表达实现免疫逃逸。
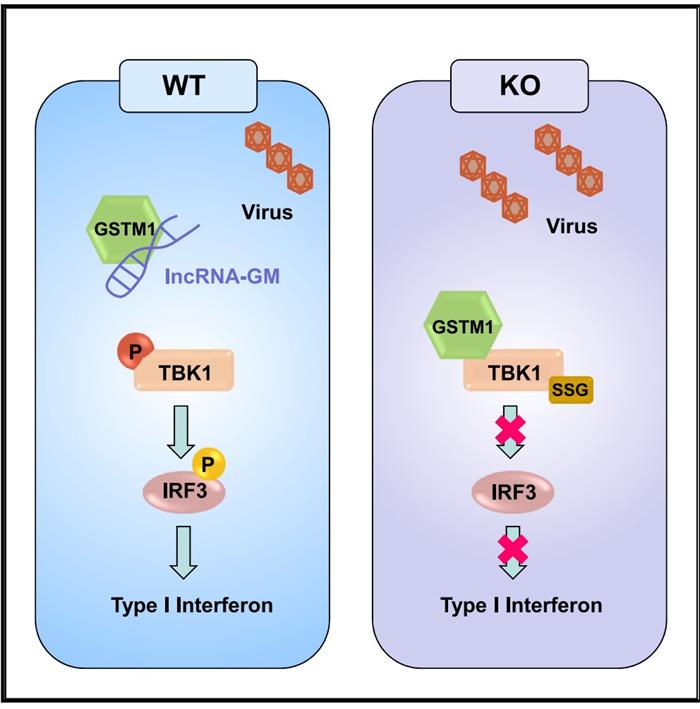
利用CHIRP技术,研究人员发现lncRNA-GM能在静息状态下结合谷胱甘肽转移酶GSTM1,通过阻止GSTM1结合TBK1调控天然免疫应答。同时,作者首次报道了GSTM1能够在病毒刺激下引起TBK1第637位半胱氨酸发生S-谷胱甘肽化修饰,进而抑制TBK1的激酶活性。通过代谢相关检测,他们发现这种修饰依赖病毒感染引起细胞内的谷胱甘肽代谢发生重编程,利用代谢物GSSG的类似物NOV-002能够显著抑制TBK1的活化及宿主的抗病毒免疫反应。
综上,曹雪涛团队发现病毒感染下调lncRNA-GM的表达, 会造成TBK1的S-谷胱甘肽化修饰水平的升高,抑制抗病毒IFN-I的产生,有助于病毒实现免疫逃逸。本研究结果为lncRNA调控抗病毒天然免疫应答提出了一种新的作用机制,并提出了代谢物GSSG和TBK1的S-谷胱甘肽化修饰在抗病毒天然免疫中的新功能。
原文链接:https://www.cell.com/immunity/fulltext/S1074-7613(20)30497-0
以往的研究表明天然免疫信号转导过程中关键蛋白的表达以及活性受到多种翻译后修饰(PTMs)的调控。长链非编码 RNA(lncRNA)是近些年新兴的研究热点,其作用机制多样,为解释病毒与机体天然免疫的博弈提供了新的可能性。lncRNA 与蛋白质分子发生相互作用并调控蛋白质的PTM,是目前细胞分化发育、功能调控及其疾病发生发展机制研究的热点。然而在抗病毒天然免疫应答调控领域,是否存在lncRNA通过影响天然免疫关键信号蛋白分子的PTM来调控抗病毒天然免疫呢?病毒感染状态下lncRNA拷贝数的变化是否会影响它与天然免疫蛋白分子的相互作用呢?病毒能否利用宿主lncRNA或蛋白PTM以利于自身免疫逃逸呢?这些问题仍未得到解答。
2020年12月15日,曹雪涛院士团队在Immunity杂志在线发表“Decreased Expression of the Host Long-Noncoding RNA-GM Facilitates Viral Escape by Inhibiting the Kinase activity TBK1 via S-glutathionylation”的文章,第一作者为浙江大学博士生王羽佳,对这些科学问题进行了深入的探讨。在这个工作中,研究人员鉴定出了一种与蛋白质 S-谷胱甘肽化修饰作用相关的lncRNA,将它命名为lncRNA-GM(Glutathionylation modification)。研究人员发现多种病毒皆能够引起lncRNA-GM的表达下调。进一步通过体外敲低lncRNA-GM以及构建lncRNA-GM缺陷小鼠,研究人员发现lncRNA-GM是宿主激活TBK1和干扰素表达所必须的,而病毒能够通过抑制其表达实现免疫逃逸。

利用CHIRP技术,研究人员发现lncRNA-GM能在静息状态下结合谷胱甘肽转移酶GSTM1,通过阻止GSTM1结合TBK1调控天然免疫应答。同时,作者首次报道了GSTM1能够在病毒刺激下引起TBK1第637位半胱氨酸发生S-谷胱甘肽化修饰,进而抑制TBK1的激酶活性。通过代谢相关检测,他们发现这种修饰依赖病毒感染引起细胞内的谷胱甘肽代谢发生重编程,利用代谢物GSSG的类似物NOV-002能够显著抑制TBK1的活化及宿主的抗病毒免疫反应。
综上,曹雪涛团队发现病毒感染下调lncRNA-GM的表达, 会造成TBK1的S-谷胱甘肽化修饰水平的升高,抑制抗病毒IFN-I的产生,有助于病毒实现免疫逃逸。本研究结果为lncRNA调控抗病毒天然免疫应答提出了一种新的作用机制,并提出了代谢物GSSG和TBK1的S-谷胱甘肽化修饰在抗病毒天然免疫中的新功能。
原文链接:https://www.cell.com/immunity/fulltext/S1074-7613(20)30497-0
