学术动态
肖俊宇研究组《Science》和《Cell Research》相继发文报道IgM和IgA组装及黏膜转运的分子机制
作者:肖俊宇 来源自:中国免疫学会 点击数:57151 发布时间:2020-06-11
免疫球蛋白是免疫系统的重要组成成分。人体中存在五类免疫球蛋白:IgA,IgD,IgE,IgG,IgM。IgM是个体发育中最先出现的抗体,也是抗原入侵时机体制造的第一类抗体,在免疫应答早期阶段发挥重要功能。IgA则是黏膜免疫系统中最主要的抗体成分,是机体抵抗病原体感染的第一道屏障,也是人体每天产生最多的抗体。区别于包括IgG在内的其他免疫球蛋白,IgM和IgA均以多聚体的形式发挥功能。在J链存在的情况下,IgM形成稳定五聚体,而IgA主要形成二聚体。同时,J链还在由多聚免疫球蛋白受体pIgR介导的IgM和IgA的黏膜转运过程中扮演重要角色。虽然这些内容是免疫学教科书里的经典内容,但很多科学问题还没有得到清晰的理解,包括IgM/IgA多聚体的组装模式、J链发挥功能的分子机制、以及pIgR特异识别分泌型IgM/IgA的机制等。肖俊宇研究组通过解析一系列高分辨率冷冻电镜结构,对这些重要的科学问题进行了系统研究。
首先,他们解析了由人源IgM-Fc五聚体、J链、以及pIgR胞外域(又称为分泌片)形成的复合体的高分辨冷冻电镜结构。结果显示,区别于教科书中传统以来描述的五角星形状,IgM-Fc采用非对称的方式形成五聚体,整体形状类似于缺少了一个角的六边形。IgM-Fc羧基端的tailpiece通过致密的疏水相互作用紧密组装在一起,形成五聚体的中心。J链填补于IgM-Fc五聚体的缺口处,同时也介导了IgM-Fc与pIgR之间的相互作用。这一工作颠覆了对IgM五聚体的传统理解,也为基于IgM抗体的药物设计奠定了基础。
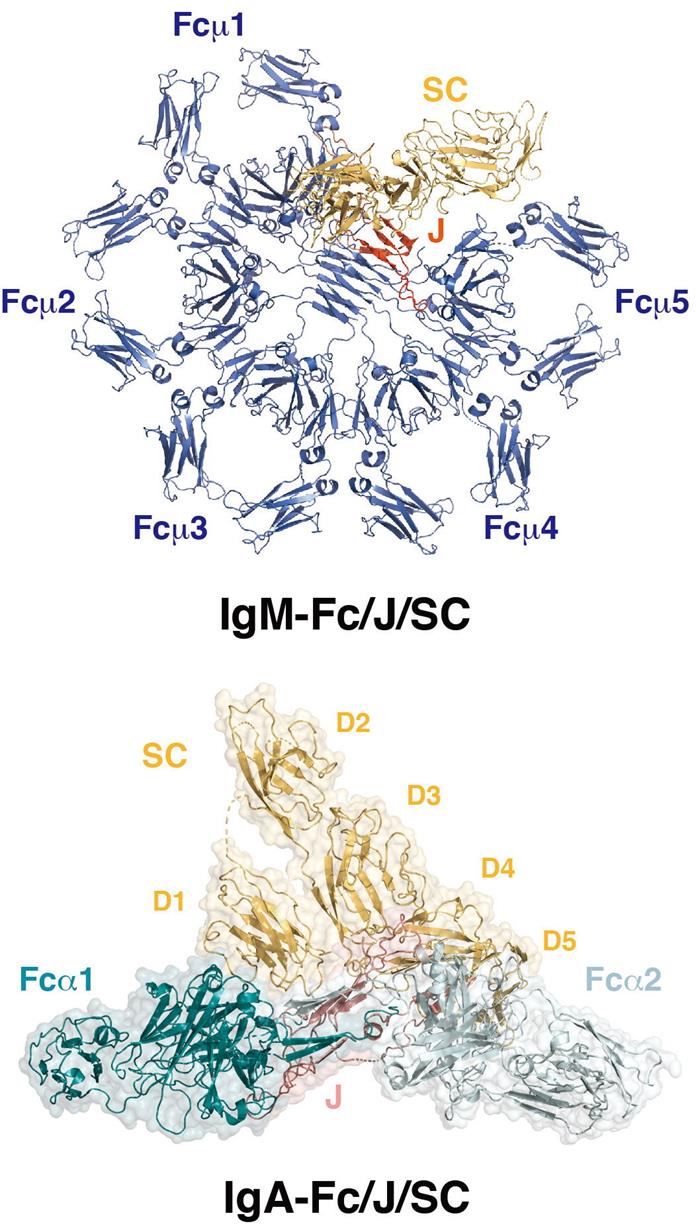
随后,他们进一步解析了人源IgA-Fc二聚体/J链/分泌片复合体的高分辨结构。与上述IgM复合体相比,J链与IgA分子产生更为致密的相互作用而稳定IgA二聚体。J链还占据了IgA特异性受体FcaRI/CD89在IgA-Fc分子一侧的结合区域,因此黏膜上的IgA分子可能会与FcaRI/CD89以有别于IgA单体的方式相互作用。除此之外,他们还研究了IgA复合体与肺炎链球菌黏附素SpsA的相互作用。由于IgA在黏膜免疫防御系统中的重要功能,许多病原菌演化出破坏其功能的机制。肺炎链球菌(Streptococcus pneumoniae)是一种革兰氏阳性菌,能够引起中耳炎、肺炎、脑膜炎等疾病。SpsA是肺炎链球菌的主要黏附蛋白。通过解析IgA复合体与SpsA形成的高级复合体的结构,该工作阐明了SpsA特异性结合人体IgA复合体的机制,为肺炎链球菌致病机理的研究提供了参考。
蛋白质与植物基因研究国家重点实验室、北京大学生命科学学院、北大清华生命科学联合中心肖俊宇研究员是上述论文的通讯作者。研究得到了国家重点研发计划、国家自然科学基金委、北京大学临床+X项目、北京大学生命科学学院启东产业创新基金的经费资助。北京大学冷冻电镜平台和高性能计算平台对数据的收集和处理给予了大力支持。
原文链接:
https://science.sciencemag.org/content/367/6481/1014
https://www.nature.com/articles/s41422-020-0336-3
首先,他们解析了由人源IgM-Fc五聚体、J链、以及pIgR胞外域(又称为分泌片)形成的复合体的高分辨冷冻电镜结构。结果显示,区别于教科书中传统以来描述的五角星形状,IgM-Fc采用非对称的方式形成五聚体,整体形状类似于缺少了一个角的六边形。IgM-Fc羧基端的tailpiece通过致密的疏水相互作用紧密组装在一起,形成五聚体的中心。J链填补于IgM-Fc五聚体的缺口处,同时也介导了IgM-Fc与pIgR之间的相互作用。这一工作颠覆了对IgM五聚体的传统理解,也为基于IgM抗体的药物设计奠定了基础。

随后,他们进一步解析了人源IgA-Fc二聚体/J链/分泌片复合体的高分辨结构。与上述IgM复合体相比,J链与IgA分子产生更为致密的相互作用而稳定IgA二聚体。J链还占据了IgA特异性受体FcaRI/CD89在IgA-Fc分子一侧的结合区域,因此黏膜上的IgA分子可能会与FcaRI/CD89以有别于IgA单体的方式相互作用。除此之外,他们还研究了IgA复合体与肺炎链球菌黏附素SpsA的相互作用。由于IgA在黏膜免疫防御系统中的重要功能,许多病原菌演化出破坏其功能的机制。肺炎链球菌(Streptococcus pneumoniae)是一种革兰氏阳性菌,能够引起中耳炎、肺炎、脑膜炎等疾病。SpsA是肺炎链球菌的主要黏附蛋白。通过解析IgA复合体与SpsA形成的高级复合体的结构,该工作阐明了SpsA特异性结合人体IgA复合体的机制,为肺炎链球菌致病机理的研究提供了参考。
蛋白质与植物基因研究国家重点实验室、北京大学生命科学学院、北大清华生命科学联合中心肖俊宇研究员是上述论文的通讯作者。研究得到了国家重点研发计划、国家自然科学基金委、北京大学临床+X项目、北京大学生命科学学院启东产业创新基金的经费资助。北京大学冷冻电镜平台和高性能计算平台对数据的收集和处理给予了大力支持。
原文链接:
https://science.sciencemag.org/content/367/6481/1014
https://www.nature.com/articles/s41422-020-0336-3
