学术动态
孟飞龙团队与叶菱秀团队《Cell》发文揭示DNA柔性在抗体基因超突变谱式中功能机制
作者:孟飞龙 来源自:中国免疫学会 点击数:16905 发布时间:2023-05-30
作为适应性免疫系统的核心,多样化的抗体分子通过特异性地识别和清除各种病原体,时刻守卫着机体的健康。抗体多样化过程通常包含两个主要步骤,(1)重组酶RAG介导的的V(D)J重排过程;(2)胞苷脱氨酶AID起始的体细胞超突变(SHM)和抗体类型转换(CSR)过程。体细胞超突变在抗体基因可变区的编码区引入高频突变。但是,超突变在抗体可变区外显子上并非均匀分布,而是偏好积累在可变区中的互补决定区(CDR)。“突变为什么具有偏好性”这一科学问题最早于1982年由著名免疫学家David Baltimore与Klaus Rajewsky提出。近40多年来,免疫学家曾尝试从多个角度去解释这一现象,但一直都没有得出令人非常信服的结论。因此,CDR偏好突变这一经典科学难题的解决亟需引入新的概念。
2023年4月24日,中科院分子细胞卓越中心孟飞龙团队与上海市免疫学研究所叶菱秀团队在《Cell》杂志在线发表了题为“Mesoscale DNA Feature in Antibody-Coding Sequence Facilitates Somatic Hypermutation”的研究论文。该研究破解了抗体基因互补决定区(CDR)偏好突变的分子基础,创新性地揭示了抗体基因编码序列DNA柔性在抗体基因超突变谱式中的重要生理意义,这一发现解决了困扰抗体研究人员40多年的长期难题,为下一代抗体基因人源化动物模型的设计奠定了理论基础。
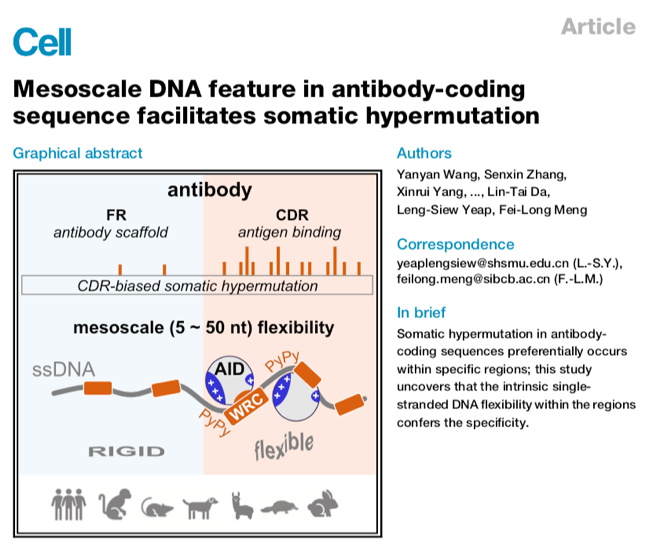
在本研究中,研究团队建立了一种高通量体外酶活测定法,发现简单的体外酶活反应便可以重现小鼠体内CDR偏好突变的特征,并发现 CDR偏好突变特征在使用体细胞超突变多样化策略的四足动物中具有进化保守性。利用巧妙的乘客等位基因小鼠模型系统,研究人员通过CRISPR/Cas9快速编辑了抗体基因CDR3区域附近的DNA序列,发现 CDR 的偏好突变特征取决于中尺度水平(5-50 bp)的DNA序列组成。随后,结合分子动力学模拟和单分子生物化学实验,研究人员证明了AID的靶向偏好直接受ssDNA柔韧性的调控。对抗体基因序列的分析表明, CDR区域编码序列在进化过程中恰恰获得了这种高度柔性的特征。最后,在 B 细胞系和小鼠模型中,将柔性 DNA 插入低频突变区 FR3,成功地将 FR 转化为类似 CDR 的热区。
该研究解答了长期困扰免疫学领域的经典难题,创新性地指出抗体基因进化过程中在DNA水平上不仅存在密码子水平的选择,还存在第二层非编码水平的选择机制,揭示了DNA柔性在CDR突变偏好中发挥的关键调控功能,为DNA力学性质调控细胞生命活动提供了实证,也提示DNA柔性等力学性质可能在其他生命活动如肿瘤的发生发展中发挥重要作用,为设计下一代抗体基因人源化动物模型的发展提供了底层理论。
该研究获得了Cell Research杂志的研究亮点专项评述,特别指出该研究解决了体细胞超突变(SHM)领域的一个重要谜团,对研究抗体基因序列进化、AID脱靶位点以及为治疗或预防病毒感染的人造序列等多个反面具有广泛的意义。

中科院分子细胞科学卓越创新中心孟飞龙研究员和上海交通大学医学院上海市免疫学研究所叶菱秀研究员为该论文的共同通讯作者,分子细胞科学卓越创新中心孟飞龙组博士生王燕燕为该论文的第一作者。该研究得到了国家重点研发计划、国家自然科学基金、上海市科技重大专项、上海市自然科学基金等资助。
论文链接:https://www.cell.com/cell/fulltext/S0092-8674(23)00327-6
2023年4月24日,中科院分子细胞卓越中心孟飞龙团队与上海市免疫学研究所叶菱秀团队在《Cell》杂志在线发表了题为“Mesoscale DNA Feature in Antibody-Coding Sequence Facilitates Somatic Hypermutation”的研究论文。该研究破解了抗体基因互补决定区(CDR)偏好突变的分子基础,创新性地揭示了抗体基因编码序列DNA柔性在抗体基因超突变谱式中的重要生理意义,这一发现解决了困扰抗体研究人员40多年的长期难题,为下一代抗体基因人源化动物模型的设计奠定了理论基础。

在本研究中,研究团队建立了一种高通量体外酶活测定法,发现简单的体外酶活反应便可以重现小鼠体内CDR偏好突变的特征,并发现 CDR偏好突变特征在使用体细胞超突变多样化策略的四足动物中具有进化保守性。利用巧妙的乘客等位基因小鼠模型系统,研究人员通过CRISPR/Cas9快速编辑了抗体基因CDR3区域附近的DNA序列,发现 CDR 的偏好突变特征取决于中尺度水平(5-50 bp)的DNA序列组成。随后,结合分子动力学模拟和单分子生物化学实验,研究人员证明了AID的靶向偏好直接受ssDNA柔韧性的调控。对抗体基因序列的分析表明, CDR区域编码序列在进化过程中恰恰获得了这种高度柔性的特征。最后,在 B 细胞系和小鼠模型中,将柔性 DNA 插入低频突变区 FR3,成功地将 FR 转化为类似 CDR 的热区。
该研究解答了长期困扰免疫学领域的经典难题,创新性地指出抗体基因进化过程中在DNA水平上不仅存在密码子水平的选择,还存在第二层非编码水平的选择机制,揭示了DNA柔性在CDR突变偏好中发挥的关键调控功能,为DNA力学性质调控细胞生命活动提供了实证,也提示DNA柔性等力学性质可能在其他生命活动如肿瘤的发生发展中发挥重要作用,为设计下一代抗体基因人源化动物模型的发展提供了底层理论。
该研究获得了Cell Research杂志的研究亮点专项评述,特别指出该研究解决了体细胞超突变(SHM)领域的一个重要谜团,对研究抗体基因序列进化、AID脱靶位点以及为治疗或预防病毒感染的人造序列等多个反面具有广泛的意义。

中科院分子细胞科学卓越创新中心孟飞龙研究员和上海交通大学医学院上海市免疫学研究所叶菱秀研究员为该论文的共同通讯作者,分子细胞科学卓越创新中心孟飞龙组博士生王燕燕为该论文的第一作者。该研究得到了国家重点研发计划、国家自然科学基金、上海市科技重大专项、上海市自然科学基金等资助。
论文链接:https://www.cell.com/cell/fulltext/S0092-8674(23)00327-6
