学术动态
王晓明/车楠团队合作揭示B细胞分化及类风湿关节炎发病的新机制
作者:王晓明 来源自:中国免疫学会 点击数:9080 发布时间:2022-08-31
B淋巴细胞分化为浆细胞是体液免疫应答的关键环节,因而需要受到严格调控,从而可以在产生强效体液免疫应答的同时防止抗体介导的自身免疫疾病发生。以往的研究已报道多种促进浆细胞分化的调控因子,如Blimp1,IRF4和XBP1等。然而,有关浆细胞分化相关的负向调节机制研究较少。
类风湿关节炎(RA)是一种常见的系统性自身免疫疾病。多种免疫细胞在参与RA发病和进展过程,其中B细胞被公认为其中起到重要促进作用的细胞亚群。B细胞剔除疗法对于缓解RA疾病活动度具有显著作用,RA也是rituximab的第一个免疫相关适应症。早期的相关性研究提示组蛋白H3K9去甲基酶JMJD1C与RA具有一定的相关性,然而其具体作用和分子机制尚不清楚。
2022年8月22日,南京医科大学基础医学院王晓明课题组与南医大第一附属医院车楠团队合作,在《Nature Immunology》杂志发表了题为“Jmjd1c demethylates Stat3 to restrain plasma cell differentiation and rheumatoid arthritis”的研究论文,报道了JMJD1C通过非经典功能去甲基化STAT3从而调控浆细胞分化和类风湿关节炎发病的作用(示意图)。
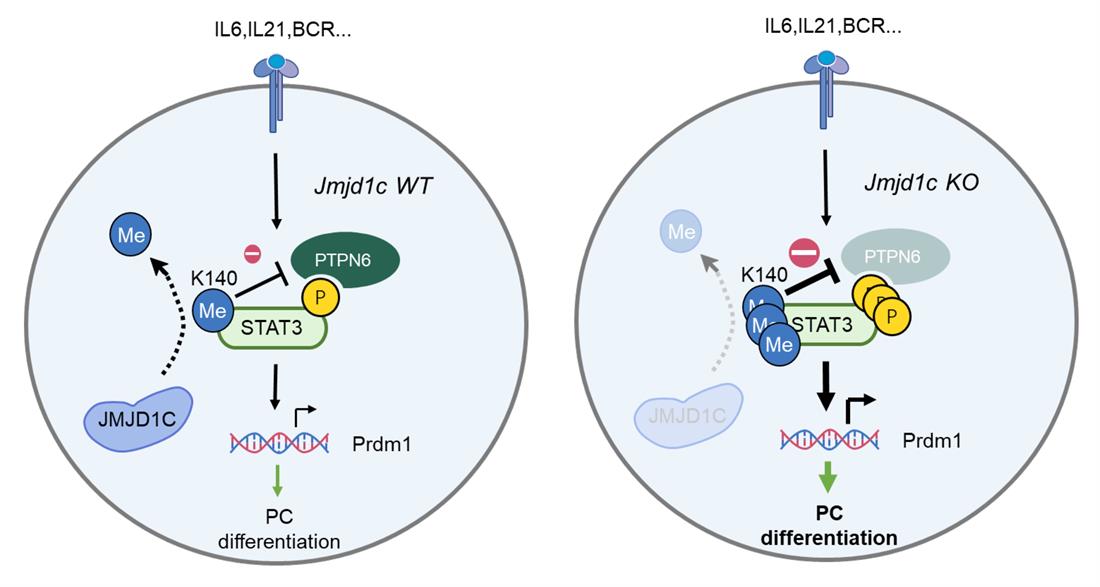
在本研究中,研究人员通过构建多种免疫细胞谱系条件性敲除小鼠模型,发现B细胞而非其他免疫细胞表达的JMJD1C可抑制小鼠类风湿关节炎疾病模型CIA发病, B细胞JMJD1C缺失导致模型小鼠体内抗胶原抗体显著上升。B细胞中JMJD1C的表达量与RA病人的疾病评分也呈现负相关。在机制上,研究者们发现, JMJD1C在B细胞中并不介导经典的H3K9组蛋白去甲基化功能,而是通过直接去甲基化STAT3这一非经典底物,抑制STAT3的磷酸化和活性来限制浆细胞的分化。JMJD1C缺失的B细胞中,STAT3的K140位点发生过度甲基化,抑制了其与磷酸酶PTPN6的相互作用从而导致STAT3维持异常长效磷酸化和活性的状态,最终导致浆细胞过度分化。生发中心B细胞也表现出向浆细胞过度/过早分化的状态,抗体亲和力成熟水平下降。通过构建STAT3K140R点突变小鼠,研究人员证明了JMJD1c缺失促进浆细胞分化的表型依赖于STAT3的K140位点。有意思的是,K140R点突变本身对于浆细胞分化的影响显著小于JMJD1C缺失所带来的影响。这些发现揭示了JMJD1C作为浆细胞分化和类风湿关节炎病理的关键负向调节因子,阐述了JMJD1C在免疫细胞中的非经典功能。同时也提示,对于B细胞分化而言,STAT3去甲基化修饰而非甲基化修饰发挥了更为关键的调控作用。这一研究成果为类风湿关节炎的精准治疗提供了潜在的靶点和生物标志物,提示JMJD1C低表达的类风湿关节炎病人可能更好的受益于B细胞靶向疗法。
南京医科大学博士研究生殷玉叶,基础医学专业本科生杨心怡和博士研究生吴舒圣为本文的共同第一作者,南京医科大学基础医学院王晓明、博士后陈晶晶及南医大一附院风湿免疫科车楠为本文的共同通讯作者。南京医科大学动物中心李建民/曾文涛,中科院上海营养与健康研究所秦骏研究员和香港大学吕力为教授为本研究提供了重要支持。本课题得到了科技部重点研发计划、国家自然科学基金委和江苏省科技厅教育厅的资助。
王晓明课题组在国家海外高层次人才项目和江苏省特聘教授项目的资助下成立于2014年,课题组致力于研究淋巴细胞尤其是B细胞应答的表观遗传调控机制,并开发相应上靶向策略。近几年的工作揭示了一系列生发中心B细胞分化和选择的重要表观遗传调控分子,研究成果以通讯或共同通讯作者发表在 J Exp Med(2020, 2018),Science Immunology(2019), Cell reports(2018)等杂志,欢迎对相关研究方向感兴趣的博士后加入团队。
原文链接: https://www.nature.com/articles/s41590-022-01287-y
类风湿关节炎(RA)是一种常见的系统性自身免疫疾病。多种免疫细胞在参与RA发病和进展过程,其中B细胞被公认为其中起到重要促进作用的细胞亚群。B细胞剔除疗法对于缓解RA疾病活动度具有显著作用,RA也是rituximab的第一个免疫相关适应症。早期的相关性研究提示组蛋白H3K9去甲基酶JMJD1C与RA具有一定的相关性,然而其具体作用和分子机制尚不清楚。
2022年8月22日,南京医科大学基础医学院王晓明课题组与南医大第一附属医院车楠团队合作,在《Nature Immunology》杂志发表了题为“Jmjd1c demethylates Stat3 to restrain plasma cell differentiation and rheumatoid arthritis”的研究论文,报道了JMJD1C通过非经典功能去甲基化STAT3从而调控浆细胞分化和类风湿关节炎发病的作用(示意图)。

JMJD1c调控浆细胞分化的机制示意图
在本研究中,研究人员通过构建多种免疫细胞谱系条件性敲除小鼠模型,发现B细胞而非其他免疫细胞表达的JMJD1C可抑制小鼠类风湿关节炎疾病模型CIA发病, B细胞JMJD1C缺失导致模型小鼠体内抗胶原抗体显著上升。B细胞中JMJD1C的表达量与RA病人的疾病评分也呈现负相关。在机制上,研究者们发现, JMJD1C在B细胞中并不介导经典的H3K9组蛋白去甲基化功能,而是通过直接去甲基化STAT3这一非经典底物,抑制STAT3的磷酸化和活性来限制浆细胞的分化。JMJD1C缺失的B细胞中,STAT3的K140位点发生过度甲基化,抑制了其与磷酸酶PTPN6的相互作用从而导致STAT3维持异常长效磷酸化和活性的状态,最终导致浆细胞过度分化。生发中心B细胞也表现出向浆细胞过度/过早分化的状态,抗体亲和力成熟水平下降。通过构建STAT3K140R点突变小鼠,研究人员证明了JMJD1c缺失促进浆细胞分化的表型依赖于STAT3的K140位点。有意思的是,K140R点突变本身对于浆细胞分化的影响显著小于JMJD1C缺失所带来的影响。这些发现揭示了JMJD1C作为浆细胞分化和类风湿关节炎病理的关键负向调节因子,阐述了JMJD1C在免疫细胞中的非经典功能。同时也提示,对于B细胞分化而言,STAT3去甲基化修饰而非甲基化修饰发挥了更为关键的调控作用。这一研究成果为类风湿关节炎的精准治疗提供了潜在的靶点和生物标志物,提示JMJD1C低表达的类风湿关节炎病人可能更好的受益于B细胞靶向疗法。
南京医科大学博士研究生殷玉叶,基础医学专业本科生杨心怡和博士研究生吴舒圣为本文的共同第一作者,南京医科大学基础医学院王晓明、博士后陈晶晶及南医大一附院风湿免疫科车楠为本文的共同通讯作者。南京医科大学动物中心李建民/曾文涛,中科院上海营养与健康研究所秦骏研究员和香港大学吕力为教授为本研究提供了重要支持。本课题得到了科技部重点研发计划、国家自然科学基金委和江苏省科技厅教育厅的资助。
王晓明课题组在国家海外高层次人才项目和江苏省特聘教授项目的资助下成立于2014年,课题组致力于研究淋巴细胞尤其是B细胞应答的表观遗传调控机制,并开发相应上靶向策略。近几年的工作揭示了一系列生发中心B细胞分化和选择的重要表观遗传调控分子,研究成果以通讯或共同通讯作者发表在 J Exp Med(2020, 2018),Science Immunology(2019), Cell reports(2018)等杂志,欢迎对相关研究方向感兴趣的博士后加入团队。
原文链接: https://www.nature.com/articles/s41590-022-01287-y
