学术动态
中山大学张辉/何欣/张译文/陈然联合广州实验室赵金存/魏雪鹏团队揭示新冠Omicron免疫逃逸新机制
作者:张辉 来源自:中国免疫学会 点击数:2150 发布时间:2024-03-26
截至2024年1月,由SARS-CoV-2引起的COVID-19已经导致超过7.74亿例确诊病例和超过701万例死亡。SARS-CoV-2具有突变速度快的特点,可在全球短时间内发生新突变株取代旧突变株的传播现象。目前,Omicron HV.1和JN.1亚型正迅速取代早期的Omicron BA.2、BA.2.75和XBB.1亚型。与之前突变株相比,Omicron感染的临床病症减轻。但由于Omicron特异性疫苗的免疫原弱也严重限制了有效疫苗的研发。
2024年3月7日,中山大学张辉/何欣/张译文/陈然团队联合广州实验室赵金存/魏雪鹏团队在Nature Immunology上发表了题为 “The receptor binding domain of SARS-CoV-2 Omicron subvariants targets Siglec-9 to decrease its immunogenicity by preventing macrophage phagocytosis”的研究论文。

课题组通过反向突变联合纳米颗粒组装技术,逐一筛选Omicron Spike蛋白RBD区域突变氨基酸对免疫原性影响。结果显示Omicron RBD的375位点,由Omicron苯丙氨酸突(F)变到Delta丝氨酸(S)时,即F375S 显著提高RBD的免疫原性。接着发现Omicron RBD的371-377位置的FAPFFAF序列对RBD纳米颗粒或包含此序列的Spike假病毒颗粒的巨噬细胞吞噬功能具有强烈的抑制作用。研究表明,Omicron RBD通过增强与巨噬细胞上的免疫检查点Siglec-9的结合,从而抑制吞噬功能作用和抗原呈递,发生免疫逃逸,为疫苗设计提供了克服免疫逃逸的关键理论支持。
为进一步提高疫苗免疫原性以及提高诱导广谱免疫应答,研究人员基于RBD结构以及位点保守性分析,设计研发BA.5(F375S/V486F/Q493R) ,命名为BA.5(SR),并于Delta RBD组成了 BA.5(SR)/Delta二价纳米颗粒疫苗,在小鼠、新西兰兔和恒河猴的实验中,均诱导出强效而广谱的中和抗体,表明其在应对Omicron及其他突变株威胁方面具有显著潜力。
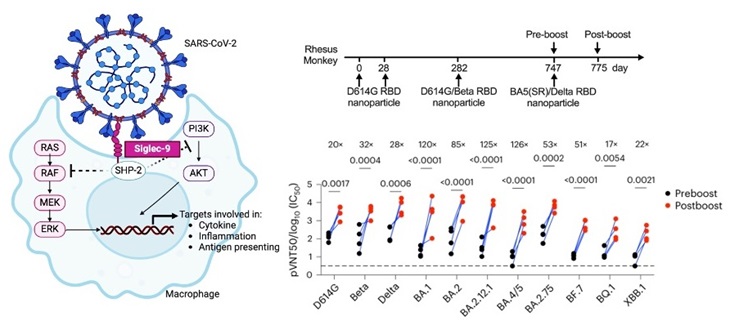
通过揭示Omicron演变出一种直接抑制巨噬细胞吞噬与抗原提呈的新功能,作为免疫逃逸的新机制,据此设计的新冠疫苗显示出强效且广谱的保护活性,为疫苗开发提供了新的思路。这一研究的成果有望在未来的疫苗战略中发挥关键作用,为全球公共卫生安全提供更可靠的保护。
中山大学中山医学院何欣副教授、张贤涛博士生、吴博霖博士生、邓洁仪博士生、张永莉博士生、广州医科大学朱爱如博士为本文的共同第一作者。中山大学张辉教授,张译文副教授、陈然副教授、广州实验室赵金存教授、魏雪鹏研究员为本文的共同通讯作者。中山医学院陈俊教授构建Siglec-9/E敲除小鼠模型并提供指导帮助。该研究得到科技部重点研发、国家自然科学基金委重大项目及面上项目和青年项目、广东省重点研发等项目资助。
文章链接:https://www.nature.com/articles/s41590-024-01776-2
2024年3月7日,中山大学张辉/何欣/张译文/陈然团队联合广州实验室赵金存/魏雪鹏团队在Nature Immunology上发表了题为 “The receptor binding domain of SARS-CoV-2 Omicron subvariants targets Siglec-9 to decrease its immunogenicity by preventing macrophage phagocytosis”的研究论文。

课题组通过反向突变联合纳米颗粒组装技术,逐一筛选Omicron Spike蛋白RBD区域突变氨基酸对免疫原性影响。结果显示Omicron RBD的375位点,由Omicron苯丙氨酸突(F)变到Delta丝氨酸(S)时,即F375S 显著提高RBD的免疫原性。接着发现Omicron RBD的371-377位置的FAPFFAF序列对RBD纳米颗粒或包含此序列的Spike假病毒颗粒的巨噬细胞吞噬功能具有强烈的抑制作用。研究表明,Omicron RBD通过增强与巨噬细胞上的免疫检查点Siglec-9的结合,从而抑制吞噬功能作用和抗原呈递,发生免疫逃逸,为疫苗设计提供了克服免疫逃逸的关键理论支持。
为进一步提高疫苗免疫原性以及提高诱导广谱免疫应答,研究人员基于RBD结构以及位点保守性分析,设计研发BA.5(F375S/V486F/Q493R) ,命名为BA.5(SR),并于Delta RBD组成了 BA.5(SR)/Delta二价纳米颗粒疫苗,在小鼠、新西兰兔和恒河猴的实验中,均诱导出强效而广谱的中和抗体,表明其在应对Omicron及其他突变株威胁方面具有显著潜力。

通过揭示Omicron演变出一种直接抑制巨噬细胞吞噬与抗原提呈的新功能,作为免疫逃逸的新机制,据此设计的新冠疫苗显示出强效且广谱的保护活性,为疫苗开发提供了新的思路。这一研究的成果有望在未来的疫苗战略中发挥关键作用,为全球公共卫生安全提供更可靠的保护。
中山大学中山医学院何欣副教授、张贤涛博士生、吴博霖博士生、邓洁仪博士生、张永莉博士生、广州医科大学朱爱如博士为本文的共同第一作者。中山大学张辉教授,张译文副教授、陈然副教授、广州实验室赵金存教授、魏雪鹏研究员为本文的共同通讯作者。中山医学院陈俊教授构建Siglec-9/E敲除小鼠模型并提供指导帮助。该研究得到科技部重点研发、国家自然科学基金委重大项目及面上项目和青年项目、广东省重点研发等项目资助。
文章链接:https://www.nature.com/articles/s41590-024-01776-2
