学术动态
宋尔卫、苏士成团队《Nature》发文揭示肿瘤环状RNA诱导抗肿瘤免疫的新机制
作者:宋尔卫 来源自:中国免疫学会 点击数:2146 发布时间:2024-03-12
免疫治疗作为一种新型的肿瘤治疗方式,通过激活自身的免疫系统,控制肿瘤进展,主要包括免疫检查点抑制剂、过继性免疫细胞治疗、肿瘤疫苗等。近几年肿瘤免疫治疗飞速发展,在黑色素瘤、血液系统肿瘤等恶性肿瘤治疗中取得了革命性突破,获得2018年诺贝尔生理医学奖。尽管如此,免疫治疗在实体瘤中的应用仍面临着治疗应答率低、有效持续时间短等瓶颈问题,其原因之一是缺少可激活抗肿瘤免疫的肿瘤特异抗原(tumour-specific antigens,TSAs)。既往发现TSA主要由蛋白编码区的非同义突变产生,然而,大部分人类癌症表现出较低的肿瘤突变负荷,且只有极少数突变基因具有抗原性。因此,筛选并鉴定强免疫原性的TSA是重新激活“肿瘤-免疫循环”的关键步骤,对开发有效的肿瘤免疫治疗至关重要。
2024年1月18日,中山大学宋尔卫/苏士成团队在《Nature》杂志发表题为“Tumour circular RNAs elicit anti-tumour immunity by encoding cryptic peptides”的研究成果,该成果发现肿瘤中的环状RNA通过非经典翻译产生免疫原性多肽,可有效诱导抗原特异性T细胞产生,激发强烈的抗肿瘤免疫反应。这一发现提示利用肿瘤环状RNA及其编码的隐肽开发疫苗可作为恶性肿瘤的免疫治疗新策略。Nature Reviews Drug Discovery发表了评论推介该项研究成果。
研究人员为了鉴定肿瘤特异抗原,对乳腺癌患者的肿瘤组织进行人白细胞抗原I类分子(HLA-I)免疫共沉淀,并通过质谱分析鉴定与HLA-I结合的多肽。通过将质谱数据与癌和癌旁组织的全外显子组测序、转录组测序以及核糖体测序数据进行匹配,研究人员虽然未能发现蛋白质编码基因组突变抗原肽,却鉴定出来源于环状RNA开放阅读框的免疫原性隐肽。其中,circFAM53B在多例乳腺癌的HLA抗原肽质谱中被发现,且在乳腺癌中普遍高表达,其成环连接处编码了特异的氨基酸序列,与线性RNA不同,提示其可能成为肿瘤特异抗原。
进一步,研究人员成功在体外合成circFAM53B,并将circFAM53B电转至树突状细胞(Dendritic cell, DC),或将其编码多肽加入DC培养,发现circFAM53B编码隐肽可与HLA-I及HLA-II结合,通过DC呈递给T细胞,从而有效激活T细胞为抗原特异的杀伤T细胞,攻击肿瘤细胞。同时,研究人员利用人源肿瘤移植瘤(patient-derived xenograft,PDX)模型证明回输负载了circFAM53B或其编码隐肽的DC可激活抗原特异T细胞,抑制肿瘤生长。
进一步,研究人员证明环状RNA编码的隐性抗原肽在免疫功能正常的小鼠体内也能诱导强烈的抗原特异性免疫反应。而在乳腺癌及黑色素瘤荷瘤小鼠中,研究人员通过静脉注射脂质体封装的环状RNA或皮下注射免疫原性隐肽联合佐剂Poly(I:C),对小鼠进行疫苗免疫接种,发现环状RNA疫苗及隐肽疫苗均可激发强烈的抗原特异性免疫反应,显著抑制肿瘤生长及转移。
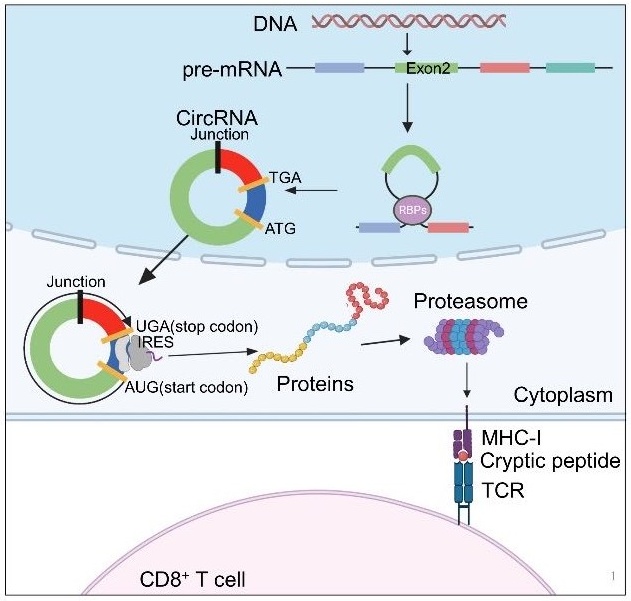
综上所述,该研究揭示了抗肿瘤免疫治疗的潜在新策略,肿瘤特异性环状RNA可通过编码隐性抗原肽驱动有效的抗原特异性免疫应答,阐明免疫原性环状RNA及其编码隐肽均可作为治疗性肿瘤疫苗,为恶性肿瘤的免疫治疗提供新思路。
中山大学孙逸仙纪念医院的黄迪医师、朱晓峰博士后、叶淑滢博士是本文的共同第一作者。宋尔卫院士、苏士成教授是本论文的共同通讯作者,该研究获得国家自然科学基金、国家重点研发等项目的资助。
文章链接:https://www.nature.com/articles/s41586-023-06834-7
研究亮点评述文章链接:https://www.nature.com/articles/d41573-024-00013-7
2024年1月18日,中山大学宋尔卫/苏士成团队在《Nature》杂志发表题为“Tumour circular RNAs elicit anti-tumour immunity by encoding cryptic peptides”的研究成果,该成果发现肿瘤中的环状RNA通过非经典翻译产生免疫原性多肽,可有效诱导抗原特异性T细胞产生,激发强烈的抗肿瘤免疫反应。这一发现提示利用肿瘤环状RNA及其编码的隐肽开发疫苗可作为恶性肿瘤的免疫治疗新策略。Nature Reviews Drug Discovery发表了评论推介该项研究成果。
研究人员为了鉴定肿瘤特异抗原,对乳腺癌患者的肿瘤组织进行人白细胞抗原I类分子(HLA-I)免疫共沉淀,并通过质谱分析鉴定与HLA-I结合的多肽。通过将质谱数据与癌和癌旁组织的全外显子组测序、转录组测序以及核糖体测序数据进行匹配,研究人员虽然未能发现蛋白质编码基因组突变抗原肽,却鉴定出来源于环状RNA开放阅读框的免疫原性隐肽。其中,circFAM53B在多例乳腺癌的HLA抗原肽质谱中被发现,且在乳腺癌中普遍高表达,其成环连接处编码了特异的氨基酸序列,与线性RNA不同,提示其可能成为肿瘤特异抗原。
进一步,研究人员成功在体外合成circFAM53B,并将circFAM53B电转至树突状细胞(Dendritic cell, DC),或将其编码多肽加入DC培养,发现circFAM53B编码隐肽可与HLA-I及HLA-II结合,通过DC呈递给T细胞,从而有效激活T细胞为抗原特异的杀伤T细胞,攻击肿瘤细胞。同时,研究人员利用人源肿瘤移植瘤(patient-derived xenograft,PDX)模型证明回输负载了circFAM53B或其编码隐肽的DC可激活抗原特异T细胞,抑制肿瘤生长。
进一步,研究人员证明环状RNA编码的隐性抗原肽在免疫功能正常的小鼠体内也能诱导强烈的抗原特异性免疫反应。而在乳腺癌及黑色素瘤荷瘤小鼠中,研究人员通过静脉注射脂质体封装的环状RNA或皮下注射免疫原性隐肽联合佐剂Poly(I:C),对小鼠进行疫苗免疫接种,发现环状RNA疫苗及隐肽疫苗均可激发强烈的抗原特异性免疫反应,显著抑制肿瘤生长及转移。

综上所述,该研究揭示了抗肿瘤免疫治疗的潜在新策略,肿瘤特异性环状RNA可通过编码隐性抗原肽驱动有效的抗原特异性免疫应答,阐明免疫原性环状RNA及其编码隐肽均可作为治疗性肿瘤疫苗,为恶性肿瘤的免疫治疗提供新思路。
中山大学孙逸仙纪念医院的黄迪医师、朱晓峰博士后、叶淑滢博士是本文的共同第一作者。宋尔卫院士、苏士成教授是本论文的共同通讯作者,该研究获得国家自然科学基金、国家重点研发等项目的资助。
文章链接:https://www.nature.com/articles/s41586-023-06834-7
研究亮点评述文章链接:https://www.nature.com/articles/d41573-024-00013-7
