学术动态
邱义福团队揭示II型细胞因子调控衰老
作者:邱义福 来源自:中国免疫学会 点击数:2538 发布时间:2024-03-04
2024年1月22日,来自北京大学未来技术学院分子医学研究所、北大-清华生命科学联合中心的邱义福团队在Immunity上发表题为“Type 2 cytokine signaling in macrophages protects from cellular senescence and organismal aging”的研究论文,首次发现白介素4(IL-4)-STAT6信号通路调控巨噬细胞衰老的重要作用,并且阐明了活化的STAT6调控DNA修复相关基因转录的分子机制。
细胞衰老和慢性炎症在机体衰老中发挥重要作用,而且都与免疫系统密切有关。在健康机体中,免疫细胞能够发现并清除衰老的细胞,所以特异地激活免疫系统可以改善老年相关疾病。反之,免疫细胞发生衰老则会加速机体的衰老。免疫细胞的衰老是近年来的一个重要发现,有望应用于肿瘤和老年性疾病的治疗。解析免疫细胞衰老的具体机制可为促进健康衰老提供理论基础。具体而言,发生衰老的免疫细胞种类、衰老的诱因和过程,以及如何逆转免疫细胞的衰老等问题都有待深入研究。
为探究免疫系统在衰老过程中的动态过程,邱义福团队通过分析GTEx数据库以及小鼠组织样本,发现II型免疫的核心分子IL4R, IL13RA1和STAT6等在老年个体中的表达明显下降。研究人员发现,和对照小鼠相比,敲除这些基因(Il4-/-; Il13-/-, Stat6-/-或Il4ra-/-)确实会加速小鼠的衰老:敲除小鼠的运动能力下降、寿命显著缩短。说明这些II型免疫核心分子的表达下降促进了衰老的发生发展。
研究团队首先从鉴定衰老细胞入手寻找机制。通过比较多个组织中衰老标记物(p16和p21)的表达,研究人员发现:和对照小鼠相比,STAT6缺失小鼠中附睾脂肪组织的p16和p21表达急剧增加。流式细胞分析表明,这些衰老标记物表达的增加主要来自巨噬细胞。检查STAT6缺失小鼠多种组织内的巨噬细胞,发现其p16和p21表达也明显上升。此外,其BMDM(小鼠骨髓来源巨噬细胞)的吞噬能力明显下降。这说明STAT6缺失会导致巨噬细胞衰老。
研究人员进一步发现Stat6巨噬细胞特异性敲除小鼠(Stat6fl/fl;Lyz2Cre)具有运动能力下降、记忆力下降等衰老症状,而且其附睾脂肪和肝脏中的p16、 p21和衰老相关分泌表型(SASP, senescence-associated secretory phenotype)的表达均显著上升。因此,STAT6缺失引起的衰老巨噬细胞是加速小鼠衰老的主要元凶。此外,骨髓移植、Clodronate巨噬细胞清除正反两方面模型都再次证实了上述结论。而rapamycin可以通过抑制巨噬细胞的SASP而改善Stat6fl/fl;Lyz2Cre小鼠衰老相关表型。
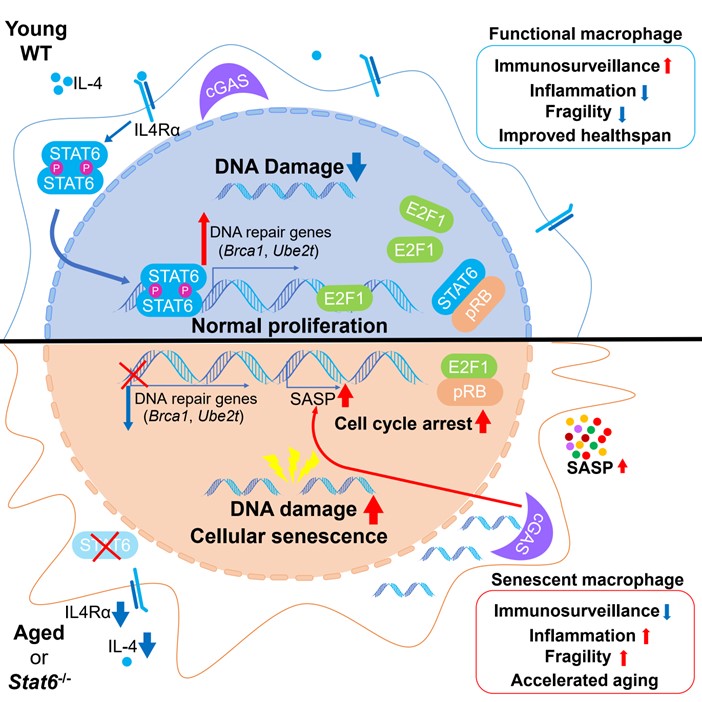
STAT6缺失为什么会引起巨噬细胞的衰老?通过高通量测序,研究人员发现DNA修复相关基因在STAT6缺失的巨噬细胞中表达明显下降。因而其DNA修复能力变弱,细胞质内积累更多的游离核基因组DNA片段。前人研究发现,游离DNA能够激活cGAS-STING通路,诱导SASP的产生以及衰老。所以,STING抑制剂H151处理STAT6缺失的BMDM能够抑制依托泊苷(Etoposide)诱导的衰老。进一步通过点突变、ChIP-seq数据分析、CUT&Tag-qPCR以及双荧光素酶报告基因等实验,研究人员证明在IL-4刺激条件下,STAT6可以作为转录因子直接结合到BRCA1和UBE2T的启动子区域,促进DNA修复相关基因的转录。至此,团队揭示了IL-4-STAT6通路调控衰老的新机制。
研究人员进一步从治疗的角度探究激活该通路能否延缓衰老。他们发现用IL-4处理巨噬细胞,能够促进DNA修复并减缓依托泊苷诱导的细胞衰老。利用肝脏表达AAV-Il4回补老年小鼠体内的IL-4水平,可以显著改善老年小鼠的衰老表型。
综上,邱义福团队发现了IL-4-STAT6通路调控巨噬细胞DNA修复的全新功能。IL-4能够激活STAT6,使后者促进DNA修复相关基因的表达。而在STAT6缺失的巨噬细胞中,DNA修复受损引起游离DNA累积,便会激活cGAS-STING通路诱发巨噬细胞的衰老。巨噬细胞衰老后丧失免疫监控能力,造成组织慢性炎症,从而加速个体衰老(图)。同时,该研究还概念验证了IL-4促进健康衰老的治疗潜力。
北京大学未来技术学院2020级硕博连读生周炤为本文第一作者。北京大学未来技术学院/北大-清华生命科学联合中心邱义福教授为本文通讯作者。本研究工作得到国家重点研发计划、国家自然科学基金、北大-清华生命科学联合中心等项目的资助。
原文链接:https://www.cell.com/immunity/fulltext/S1074-7613(24)00026-8
细胞衰老和慢性炎症在机体衰老中发挥重要作用,而且都与免疫系统密切有关。在健康机体中,免疫细胞能够发现并清除衰老的细胞,所以特异地激活免疫系统可以改善老年相关疾病。反之,免疫细胞发生衰老则会加速机体的衰老。免疫细胞的衰老是近年来的一个重要发现,有望应用于肿瘤和老年性疾病的治疗。解析免疫细胞衰老的具体机制可为促进健康衰老提供理论基础。具体而言,发生衰老的免疫细胞种类、衰老的诱因和过程,以及如何逆转免疫细胞的衰老等问题都有待深入研究。
为探究免疫系统在衰老过程中的动态过程,邱义福团队通过分析GTEx数据库以及小鼠组织样本,发现II型免疫的核心分子IL4R, IL13RA1和STAT6等在老年个体中的表达明显下降。研究人员发现,和对照小鼠相比,敲除这些基因(Il4-/-; Il13-/-, Stat6-/-或Il4ra-/-)确实会加速小鼠的衰老:敲除小鼠的运动能力下降、寿命显著缩短。说明这些II型免疫核心分子的表达下降促进了衰老的发生发展。
研究团队首先从鉴定衰老细胞入手寻找机制。通过比较多个组织中衰老标记物(p16和p21)的表达,研究人员发现:和对照小鼠相比,STAT6缺失小鼠中附睾脂肪组织的p16和p21表达急剧增加。流式细胞分析表明,这些衰老标记物表达的增加主要来自巨噬细胞。检查STAT6缺失小鼠多种组织内的巨噬细胞,发现其p16和p21表达也明显上升。此外,其BMDM(小鼠骨髓来源巨噬细胞)的吞噬能力明显下降。这说明STAT6缺失会导致巨噬细胞衰老。
研究人员进一步发现Stat6巨噬细胞特异性敲除小鼠(Stat6fl/fl;Lyz2Cre)具有运动能力下降、记忆力下降等衰老症状,而且其附睾脂肪和肝脏中的p16、 p21和衰老相关分泌表型(SASP, senescence-associated secretory phenotype)的表达均显著上升。因此,STAT6缺失引起的衰老巨噬细胞是加速小鼠衰老的主要元凶。此外,骨髓移植、Clodronate巨噬细胞清除正反两方面模型都再次证实了上述结论。而rapamycin可以通过抑制巨噬细胞的SASP而改善Stat6fl/fl;Lyz2Cre小鼠衰老相关表型。
STAT6缺失为什么会引起巨噬细胞的衰老?通过高通量测序,研究人员发现DNA修复相关基因在STAT6缺失的巨噬细胞中表达明显下降。因而其DNA修复能力变弱,细胞质内积累更多的游离核基因组DNA片段。前人研究发现,游离DNA能够激活cGAS-STING通路,诱导SASP的产生以及衰老。所以,STING抑制剂H151处理STAT6缺失的BMDM能够抑制依托泊苷(Etoposide)诱导的衰老。进一步通过点突变、ChIP-seq数据分析、CUT&Tag-qPCR以及双荧光素酶报告基因等实验,研究人员证明在IL-4刺激条件下,STAT6可以作为转录因子直接结合到BRCA1和UBE2T的启动子区域,促进DNA修复相关基因的转录。至此,团队揭示了IL-4-STAT6通路调控衰老的新机制。
研究人员进一步从治疗的角度探究激活该通路能否延缓衰老。他们发现用IL-4处理巨噬细胞,能够促进DNA修复并减缓依托泊苷诱导的细胞衰老。利用肝脏表达AAV-Il4回补老年小鼠体内的IL-4水平,可以显著改善老年小鼠的衰老表型。
综上,邱义福团队发现了IL-4-STAT6通路调控巨噬细胞DNA修复的全新功能。IL-4能够激活STAT6,使后者促进DNA修复相关基因的表达。而在STAT6缺失的巨噬细胞中,DNA修复受损引起游离DNA累积,便会激活cGAS-STING通路诱发巨噬细胞的衰老。巨噬细胞衰老后丧失免疫监控能力,造成组织慢性炎症,从而加速个体衰老(图)。同时,该研究还概念验证了IL-4促进健康衰老的治疗潜力。

图:IL-4-STAT6信号通路通过促进DNA修复延缓衰老
北京大学未来技术学院2020级硕博连读生周炤为本文第一作者。北京大学未来技术学院/北大-清华生命科学联合中心邱义福教授为本文通讯作者。本研究工作得到国家重点研发计划、国家自然科学基金、北大-清华生命科学联合中心等项目的资助。
原文链接:https://www.cell.com/immunity/fulltext/S1074-7613(24)00026-8
