学术动态
王莹/时玉舫团队合作揭示胸腺油酸影响外周T细胞亚群分化倾向性的机制
作者:王莹 来源自:中国免疫学会 点击数:5074 发布时间:2023-12-26
在漫长的物种进化过程中,胸腺最早出现于有颌类动物,并呈现结构和功能的高度保守,是T细胞发育的重要场所,对机体免疫稳态建立与维持至关重要。由骨髓产生的淋系前体细胞定植于胸腺后,在胸腺上皮细胞提供的系列信号的作用下,开启T淋巴细胞的发育过程。在经历CD4-CD8-双阴性(Double Negative,DN)和CD4+CD8+双阳性(Double Positive,DP)阶段后,胸腺细胞通过阳性、阴性选择发育为CD4+或CD8+单阳性(Single Positive,SP)细胞,离开胸腺,成为外周初始T细胞。当其被活化并接受不同细胞因子等刺激时,初始T细胞分化为不同亚群,这一过程与能量代谢改变和表观遗传调控密切相关。然而,T细胞在发育过程中所接触的信号是否可以通过代谢与表观遗传调控影响其成熟后的分化命运尚不清楚。
2023年12月7日,中国科学院上海营养与健康研究所王莹研究员和苏州大学转化医学研究院时玉舫教授在Nature Immunology在线发表题为“Oleic Acid Availability Impacts Thymocyte Preprogramming and Subsequent Peripheral Treg Cell Differentiation”的研究,该研究发现胸腺基质微环境中油酸可利用性影响并赋予发育中T细胞的表观遗传学印记,使其成熟后向调节性T细胞(regulatory T cells, Treg)分化的潜能显著增加,揭示T细胞分化命运调控的新窗口与新机制。
油酸是机体内重要营养物质,可以从饮食中摄取也可以由自身合成获得。机体内催化油酸合成的限速酶是硬脂酰辅酶A去饱和酶(stearoyl CoA desaturase, SCD)。SCD通过催化硬脂酸中的第9 号和第10 号碳原子之间化学键的去饱和反应生成油酸。小鼠中共有4个SCD亚型,其中SCD1的结构在物种间最为保守。利用SCD1缺失(SCD1-/-)小鼠,研究人员发现SCD1的缺失显著增加外周血、淋巴结以及主要组织器官中Foxp3+ Treg的数量与比例,赋予其对实验性自身免疫性脑脊髓炎(Experimental autoimmune encephalomyelitis, EAE)的抵抗能力。来源于SCD1-/-小鼠的初始CD4+ T细胞在体外Treg诱导分化条件下或输注到Rag2-/-小鼠中均表现出Treg分化的显著增强。然而,在T细胞中条件性敲除SCD1时,小鼠的Treg未受到影响。利用骨髓共移植实验,研究证明不论是野生小鼠的骨髓还是SCD1-/-小鼠的骨髓,只要在SCD1缺失小鼠中完成发育,就能获得Treg分化的偏好性。因此,SCD1缺失微环境是影响T细胞发育,使其具有更强Treg分化倾向的关键。为此,研究团队进行了胸腺移植和不同胸腺细胞亚群共移植实验,研究揭示SCD1缺失的胸腺微环境,对胸腺细胞从DN2向DN3分化过程中产生重要影响,决定其成熟后向Treg分化的偏好性。
在T细胞体外发育系统中,研究人员证明SCD1抑制剂处理的胸腺细胞在发育到DN3阶段时也表现出向Treg的分化倾向,而且油酸回补可以逆转这一过程,提示T细胞在发育过程中油酸的可利用性可以影响成熟T细胞的外周分化潜能。通过构建SCD1在胸腺不同类型细胞中的条件性敲除小鼠,研究明确胸腺中的油酸水平受到胸腺上皮细胞中SCD1活性的调控。胸腺上皮细胞产生油酸水平的降低会提升胸腺细胞内DOT1L活性,通过H3K79me2修饰促进DN3胸腺细胞中Atp2a2基因座的染色质开放水平,这一特征由DN3阶段一直保留至初始CD4+ T细胞。ATP2A2是内质网上的钙离子泵,使初始CD4+ T细胞在接受T细胞信号转导时通过调控胞内的钙离子信号,促进NFAT入核以及其对Treg分化命运关键因子Foxp3的转录调控。
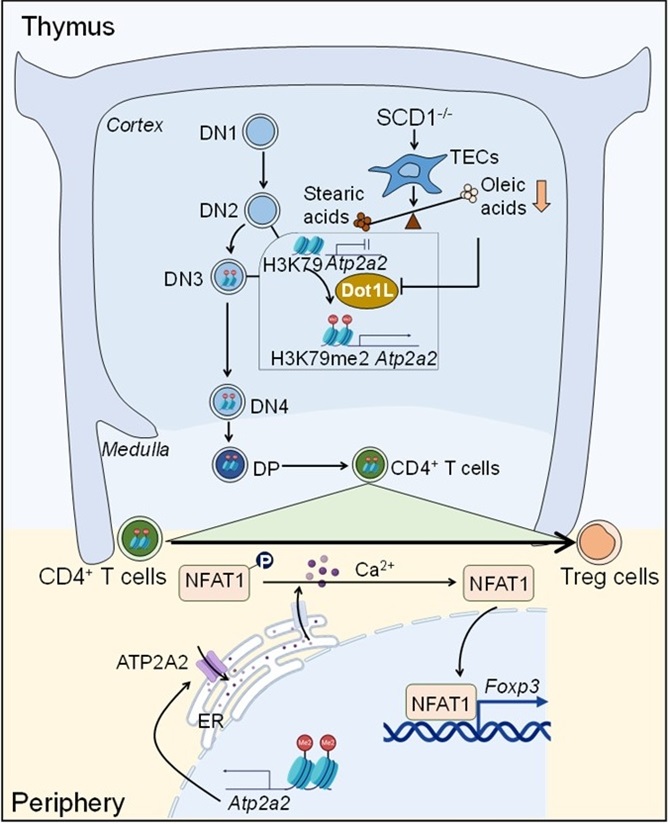
该研究首次揭示胸腺基质微环境中的油酸信号影响和预编程外周T细胞亚群分化偏好性的细胞与分子机制,不仅为理解不同生理病理环境中T细胞免疫调控机制的认识提供了新视角,也为Treg的定向高效诱导及其在器官移植、自身免疫性疾病等治疗中的应用提供新策略与新方向。
中国科学院上海营养与健康研究所博士后林良宇、博士生胡明源为该论文的共同第一作者。中国科学院上海营养与健康研究所王莹研究员、苏州大学转化医学研究院时玉舫教授为论文的共同通讯作者。该工作得到中国科学院上海营养与健康研究所孔祥银研究员、中国科学院干细胞与再生医学创新研究院王金勇研究员、以及上海科技大学林立研究员的合作支持。研究工作获得科技部国家重点研发计划项目、国家自然科学基金委、中国出生缺陷救助基金会等资助,以及中国科学院上海营养与健康研究所所级公共技术平台和动物平台的支持。
原文链接:https://www.nature.com/articles/s41590-023-01672-1
2023年12月7日,中国科学院上海营养与健康研究所王莹研究员和苏州大学转化医学研究院时玉舫教授在Nature Immunology在线发表题为“Oleic Acid Availability Impacts Thymocyte Preprogramming and Subsequent Peripheral Treg Cell Differentiation”的研究,该研究发现胸腺基质微环境中油酸可利用性影响并赋予发育中T细胞的表观遗传学印记,使其成熟后向调节性T细胞(regulatory T cells, Treg)分化的潜能显著增加,揭示T细胞分化命运调控的新窗口与新机制。
油酸是机体内重要营养物质,可以从饮食中摄取也可以由自身合成获得。机体内催化油酸合成的限速酶是硬脂酰辅酶A去饱和酶(stearoyl CoA desaturase, SCD)。SCD通过催化硬脂酸中的第9 号和第10 号碳原子之间化学键的去饱和反应生成油酸。小鼠中共有4个SCD亚型,其中SCD1的结构在物种间最为保守。利用SCD1缺失(SCD1-/-)小鼠,研究人员发现SCD1的缺失显著增加外周血、淋巴结以及主要组织器官中Foxp3+ Treg的数量与比例,赋予其对实验性自身免疫性脑脊髓炎(Experimental autoimmune encephalomyelitis, EAE)的抵抗能力。来源于SCD1-/-小鼠的初始CD4+ T细胞在体外Treg诱导分化条件下或输注到Rag2-/-小鼠中均表现出Treg分化的显著增强。然而,在T细胞中条件性敲除SCD1时,小鼠的Treg未受到影响。利用骨髓共移植实验,研究证明不论是野生小鼠的骨髓还是SCD1-/-小鼠的骨髓,只要在SCD1缺失小鼠中完成发育,就能获得Treg分化的偏好性。因此,SCD1缺失微环境是影响T细胞发育,使其具有更强Treg分化倾向的关键。为此,研究团队进行了胸腺移植和不同胸腺细胞亚群共移植实验,研究揭示SCD1缺失的胸腺微环境,对胸腺细胞从DN2向DN3分化过程中产生重要影响,决定其成熟后向Treg分化的偏好性。
在T细胞体外发育系统中,研究人员证明SCD1抑制剂处理的胸腺细胞在发育到DN3阶段时也表现出向Treg的分化倾向,而且油酸回补可以逆转这一过程,提示T细胞在发育过程中油酸的可利用性可以影响成熟T细胞的外周分化潜能。通过构建SCD1在胸腺不同类型细胞中的条件性敲除小鼠,研究明确胸腺中的油酸水平受到胸腺上皮细胞中SCD1活性的调控。胸腺上皮细胞产生油酸水平的降低会提升胸腺细胞内DOT1L活性,通过H3K79me2修饰促进DN3胸腺细胞中Atp2a2基因座的染色质开放水平,这一特征由DN3阶段一直保留至初始CD4+ T细胞。ATP2A2是内质网上的钙离子泵,使初始CD4+ T细胞在接受T细胞信号转导时通过调控胞内的钙离子信号,促进NFAT入核以及其对Treg分化命运关键因子Foxp3的转录调控。

该研究首次揭示胸腺基质微环境中的油酸信号影响和预编程外周T细胞亚群分化偏好性的细胞与分子机制,不仅为理解不同生理病理环境中T细胞免疫调控机制的认识提供了新视角,也为Treg的定向高效诱导及其在器官移植、自身免疫性疾病等治疗中的应用提供新策略与新方向。
中国科学院上海营养与健康研究所博士后林良宇、博士生胡明源为该论文的共同第一作者。中国科学院上海营养与健康研究所王莹研究员、苏州大学转化医学研究院时玉舫教授为论文的共同通讯作者。该工作得到中国科学院上海营养与健康研究所孔祥银研究员、中国科学院干细胞与再生医学创新研究院王金勇研究员、以及上海科技大学林立研究员的合作支持。研究工作获得科技部国家重点研发计划项目、国家自然科学基金委、中国出生缺陷救助基金会等资助,以及中国科学院上海营养与健康研究所所级公共技术平台和动物平台的支持。
原文链接:https://www.nature.com/articles/s41590-023-01672-1
