学术动态
浙江大学周青/俞晓敏团队合作发现IL-1R1突变导致的新自身炎症性疾病LIRSA并开发出靶向IL-1的新药物Rilabnacept
作者:周青 来源自:中国免疫学会 点击数:15392 发布时间:2023-06-30
2023年6月13日,浙江大学生命科学研究院周青课题组、浙江大学良渚实验室俞晓敏课题组联合温州医科大学附属第二医院儿童风湿科郑雯洁主任在Immunity上发表题为“Identification of an IL-1 receptor mutation driving autoinflammation directs IL-1-targeted drug design”的研究论文,首次报道了人类IL-1R1(p.Lys131Glu)错义突变破坏了IL-1R1与其拮抗剂配体IL-1Ra的结合,导致IL-1信号通路持续不受控地激活,引起炎症的自身炎症反应,在临床上表现为慢性复发性多灶性骨髓炎(CRMO)。揭示的发病机制指导患者的靶向治疗,取得了极佳的治疗效果。并且,根据发现的这一突变只破坏IL-1R1与IL-1Ra的结合,不影响其与IL-1α/β结合的特性,作者设计出一种新的IL-1抑制剂rilabnacept,它可以捕获IL-1α和IL-1β,但与IL-1Ra的亲和力低,保持其在体内抑制IL-1的功能,从而加速抑制炎症的效果。
本研究诊断的患儿自出生起反复关节肿痛10余年,综合各项临床表征和实验室生化检测,患儿前期被诊断为CRMO,但始终未找到有效的治疗方案。周青课题组分析患儿及其家系的全外显子测序结果发现患者IL1R1基因携带一个新发突变p.Lys131Glu(K131E)。进一步通过Sanger测序验证病人确实携带IL1R1杂合突变后,作者从病人全血中分别分离了血清和外周血单个核细胞(PBMCs)。血清细胞因子检测发现病人血清中促炎细胞因子IL-1β、IL-6、IL-8等水平显著升高,转录组学分析发现病人PBMCs中,IL-1调控的NF-κB和MAPK炎症信号通路基因转录水平显著上升。通过质谱流式(CyTOF)技术分析患者PBMCs发现单核细胞是异常表达IL-1β和IL-8的主要效应细胞。单细胞转录组学发现相比于健康对照,患者的PBMCs中有一群异常扩增的低密度粒细胞(low density of granulocytes,LDGs),这群细胞高表达NF-κB信号通路中的信号因子,是IL1R1突变患者的炎症发生的重要效应细胞。
作者通过蛋白结构模拟,分子动力学分析和一系列体外细胞实验证明K131E突变抑制IL-1R1与其拮抗蛋白IL-1Ra的相互作用,但不影响与IL-1α/β的结合,考虑到IL-1α/β的转录也受到自身调控的IL-1通路的激活,因此K131E突变导致IL-1信号通路不受抑制的持续激活。提取PBMCs进行体外实验,也证明患者的PBMCs被IL-1β激活后无法被IL-1Ra有效抑制,但是靶向IL-1β(canakinumab)或靶向IL-1R1的单抗能抑制患者的PBMCs的炎症水平。对IL-1R1 K131位点在物种之间的保守性分析发现,绝大多数物种中该位点以带正电荷的赖氨酸或者精氨酸存在。通过结构模拟,Fold-X预测和生化实验证明只有当K131位点发生电荷翻转时(突变成谷氨酸E或天冬氨酸D),IL-1R1与IL-1Ra的结合受到抑制。
人的IL-1R1 K131位点对应小鼠mIL-1R1的R134位点。小鼠R134E突变也能明显抑制mIL-1R1与mIL-1Ra的结合。进一步构建了C57BL/6背景的Il1r1R134E/R134E突变的小鼠。与患者相似,相比于野生型小鼠,Il1r1R134E/R134E突变小鼠的PBMCs在体外对mIL-1Ra的抑制作用无响应。并且体内实验也证明注射mIL-1Ra能有效抑制mIL-1β对野生型小鼠的体内的炎症激活,但Il1r1R134E/R134E突变小鼠对mIL-1Ra毫无响应。相比于野生型小鼠,突变小鼠对胶原抗体诱导的类风湿性关节炎(CAIA)更为敏感,表型更加严重。利用突变小鼠骨髓来源的巨噬细胞(BMDMs)进行体外诱导破骨细胞分化实验,进一步证明不受控的IL-1信号导致的破骨细胞异常分化是导致溶骨性病变的直接原因。
基于致病机制作者提出靶向IL-1β(canakinumab)的治疗方案,经过几个月的治疗,病人体内炎症得到有效控制,骨髓炎表型得到明显缓解,患者行动能力和生活质量显著提高。
作者根据发现的K131E突变只破坏IL-1R1与IL-1Ra的结合,不影响其与IL-1α/β结合的特性,创新设计了一种新的靶向IL-1的药物。以ARCALYST为商标名的利纳西普(Rilonacept),是通过串联IL-1RAP和IL-1R1的细胞外区域和人IgG1的Fc片段组成融合蛋白,形成的二聚体可以识别结合IL-1α/β/Ra,但不行使信号传递功能,因此又被成为IL-1的陷阱蛋白(Trap)。该药物已被美国食品和药物管理局(FDA)批准,以用于治疗冷吡啉相关周期性综合征(CAPS),DIRA和复发性心包炎(Recurrent pericarditis,RP)。但是无差别的识别结合IL-1Ra不仅降低药物结合IL-1α/β的效率,也削弱了IL-1Ra这一天然抑制剂的功效,无疑极大的限制了rilonacept的药效。作者巧妙的将K131E突变引入该融合蛋白,创造出新的特异性结合IL-1α/β的新药(rilabnacept)。体外细胞实验和动物模型实验均证明rilabnacept拥有更强的抑制IL-1的功能。
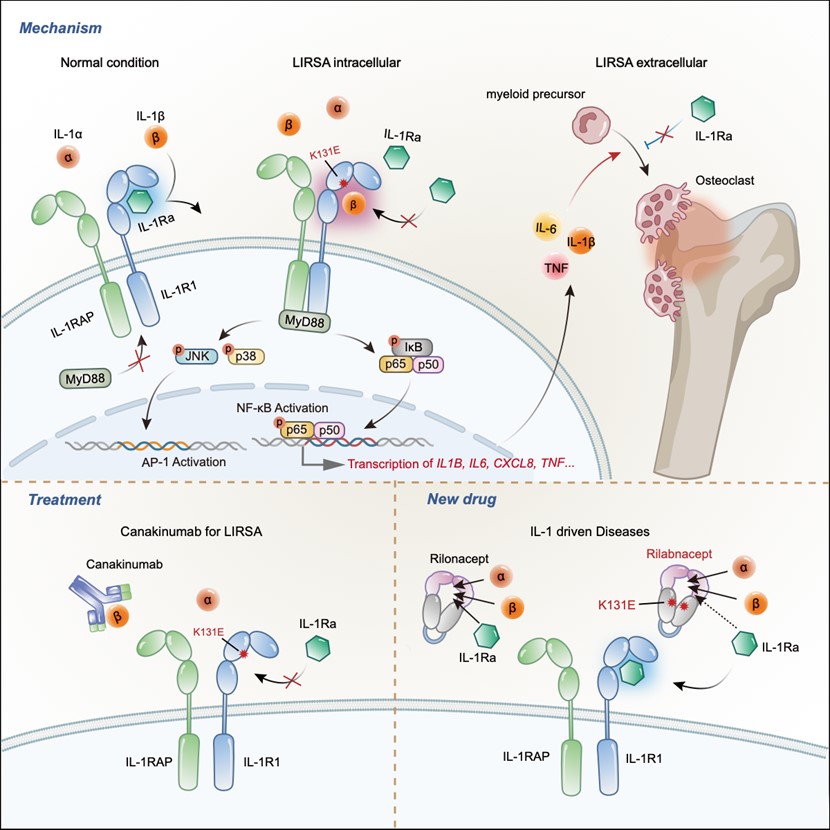
基于来自患者细胞的数据、体外生化实验和基因突变小鼠数据,该研究不仅确定了一种新的由致病基因IL1R1突变引起的自身炎症性疾病(作者命名该疾病为Loss of IL-1R1 Sensitivity to IL-1Ra ,LIRSA),而且阐明了致病机制,为患者提供了有效的临床治疗。并且基于突变的机制,作者设计出一种新的IL-1抑制剂,能更有效治疗IL-1介导的疾病。
文章链接:https://www.cell.com/immunity/fulltext/S1074-7613(23)00231-5
本研究诊断的患儿自出生起反复关节肿痛10余年,综合各项临床表征和实验室生化检测,患儿前期被诊断为CRMO,但始终未找到有效的治疗方案。周青课题组分析患儿及其家系的全外显子测序结果发现患者IL1R1基因携带一个新发突变p.Lys131Glu(K131E)。进一步通过Sanger测序验证病人确实携带IL1R1杂合突变后,作者从病人全血中分别分离了血清和外周血单个核细胞(PBMCs)。血清细胞因子检测发现病人血清中促炎细胞因子IL-1β、IL-6、IL-8等水平显著升高,转录组学分析发现病人PBMCs中,IL-1调控的NF-κB和MAPK炎症信号通路基因转录水平显著上升。通过质谱流式(CyTOF)技术分析患者PBMCs发现单核细胞是异常表达IL-1β和IL-8的主要效应细胞。单细胞转录组学发现相比于健康对照,患者的PBMCs中有一群异常扩增的低密度粒细胞(low density of granulocytes,LDGs),这群细胞高表达NF-κB信号通路中的信号因子,是IL1R1突变患者的炎症发生的重要效应细胞。
作者通过蛋白结构模拟,分子动力学分析和一系列体外细胞实验证明K131E突变抑制IL-1R1与其拮抗蛋白IL-1Ra的相互作用,但不影响与IL-1α/β的结合,考虑到IL-1α/β的转录也受到自身调控的IL-1通路的激活,因此K131E突变导致IL-1信号通路不受抑制的持续激活。提取PBMCs进行体外实验,也证明患者的PBMCs被IL-1β激活后无法被IL-1Ra有效抑制,但是靶向IL-1β(canakinumab)或靶向IL-1R1的单抗能抑制患者的PBMCs的炎症水平。对IL-1R1 K131位点在物种之间的保守性分析发现,绝大多数物种中该位点以带正电荷的赖氨酸或者精氨酸存在。通过结构模拟,Fold-X预测和生化实验证明只有当K131位点发生电荷翻转时(突变成谷氨酸E或天冬氨酸D),IL-1R1与IL-1Ra的结合受到抑制。
人的IL-1R1 K131位点对应小鼠mIL-1R1的R134位点。小鼠R134E突变也能明显抑制mIL-1R1与mIL-1Ra的结合。进一步构建了C57BL/6背景的Il1r1R134E/R134E突变的小鼠。与患者相似,相比于野生型小鼠,Il1r1R134E/R134E突变小鼠的PBMCs在体外对mIL-1Ra的抑制作用无响应。并且体内实验也证明注射mIL-1Ra能有效抑制mIL-1β对野生型小鼠的体内的炎症激活,但Il1r1R134E/R134E突变小鼠对mIL-1Ra毫无响应。相比于野生型小鼠,突变小鼠对胶原抗体诱导的类风湿性关节炎(CAIA)更为敏感,表型更加严重。利用突变小鼠骨髓来源的巨噬细胞(BMDMs)进行体外诱导破骨细胞分化实验,进一步证明不受控的IL-1信号导致的破骨细胞异常分化是导致溶骨性病变的直接原因。
基于致病机制作者提出靶向IL-1β(canakinumab)的治疗方案,经过几个月的治疗,病人体内炎症得到有效控制,骨髓炎表型得到明显缓解,患者行动能力和生活质量显著提高。
作者根据发现的K131E突变只破坏IL-1R1与IL-1Ra的结合,不影响其与IL-1α/β结合的特性,创新设计了一种新的靶向IL-1的药物。以ARCALYST为商标名的利纳西普(Rilonacept),是通过串联IL-1RAP和IL-1R1的细胞外区域和人IgG1的Fc片段组成融合蛋白,形成的二聚体可以识别结合IL-1α/β/Ra,但不行使信号传递功能,因此又被成为IL-1的陷阱蛋白(Trap)。该药物已被美国食品和药物管理局(FDA)批准,以用于治疗冷吡啉相关周期性综合征(CAPS),DIRA和复发性心包炎(Recurrent pericarditis,RP)。但是无差别的识别结合IL-1Ra不仅降低药物结合IL-1α/β的效率,也削弱了IL-1Ra这一天然抑制剂的功效,无疑极大的限制了rilonacept的药效。作者巧妙的将K131E突变引入该融合蛋白,创造出新的特异性结合IL-1α/β的新药(rilabnacept)。体外细胞实验和动物模型实验均证明rilabnacept拥有更强的抑制IL-1的功能。

基于来自患者细胞的数据、体外生化实验和基因突变小鼠数据,该研究不仅确定了一种新的由致病基因IL1R1突变引起的自身炎症性疾病(作者命名该疾病为Loss of IL-1R1 Sensitivity to IL-1Ra ,LIRSA),而且阐明了致病机制,为患者提供了有效的临床治疗。并且基于突变的机制,作者设计出一种新的IL-1抑制剂,能更有效治疗IL-1介导的疾病。
文章链接:https://www.cell.com/immunity/fulltext/S1074-7613(23)00231-5
